
| A. | NaOH是只含离子键的离子化合物 | |
| B. | HCl溶于水没有破坏共价键 | |
| C. | 碳在O2中燃烧时,破坏碳和O2中化学键吸收的总能量大于形成CO2中化学键释放的总能量 | |
| D. | 在Cl2+2NaBr=2NaCl+Br2反应过程中有离子键和共价键的断裂,也有离子键和共价键形成 |
分析 A.含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物;
B.HCl溶于水时电离生成氢离子和氯离子;
C.碳在氧气中燃烧是放热反应,断键吸收能量,成键放出能量;
D.氯气、溴中只含共价键,NaBr、NaCl中只含离子键.
解答 解:A.含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,NaOH中含有离子键和共价键,所以属于离子化合物,故A错误;
B.HCl溶于水时电离生成氢离子和氯离子,所以化学键被破坏,故B错误;
C.断键吸收能量,成键放出能量,碳在氧气中燃烧是放热反应,说明破坏碳和O2中化学键吸收的总能量小于形成CO2中化学键释放的总能量,故C错误;
D.氯气、溴中只含共价键,NaBr、NaCl中只含离子键,在Cl2+2NaBr=2NaCl+Br2反应过程中氯气中的共价键、NaBr中的离子键被破坏,NaCl中的离子键和溴中的共价键形成,所以该反应中有离子键和共价键的断裂,也有离子键和共价键形成,故D正确;
故选D.
点评 本题考查化学键、化合物类型判断及反应热,属于基础题,明确基本概念内涵及反应实质是解本题关键,注意B中被破坏的不是离子键而是共价键,题目难度不大.


科目:高中化学 来源: 题型:实验题
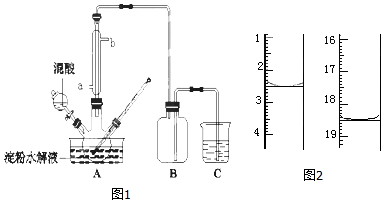
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | ① | ② | ③ |
| 电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
| Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
| A. | 对比实验①②可知,降低pH可以提高Cr2O72-的去除率 | |
| B. | 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O | |
| C. | 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72-被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属单质M能从N的化合物中置换出非金属单质N | |
| B. | 在反应中M原子比N原子得到更多电子 | |
| C. | M的气态氢化物稳定性比N弱 | |
| D. | M的氧化物对应水化物的酸性比N强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
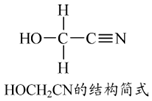 锌是人体必需的微量元素,明朝(天工开物)中有世界上最早的关于炼锌技术的记载.回答下列问题:
锌是人体必需的微量元素,明朝(天工开物)中有世界上最早的关于炼锌技术的记载.回答下列问题: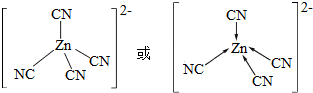 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com