
分析 (1)含有弱离子的盐能发生水解;
(2)这几种物质中,能和强碱、强酸反应的物质为弱酸的酸式盐,HCO3-电离程度小于水解程度,其溶液呈碱性;
(3)向氨水中加入氯化铵抑制一水合氨电离;
(4)NH3•H2O为弱电解质,不能完全电离;根据电荷守恒分析离子浓度关系;
(5)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的$\frac{1}{10}$,为0.01mol/L.
解答 解:(1)含有弱离子的盐能发生水解,碳酸钠和碳酸氢钠都是含有弱离子的盐,能发生水解,故选①②;
(2)这几种物质中,能和强碱、强酸反应的物质是碳酸氢钠,HCO3-水解程度大于电离程度,但程度都较小,溶液呈碱性,溶液中HCO3-和水都电离生成氢氧根离子,则溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+);
(3)向氨水中加入氯化铵,溶液中铵根离子浓度增大,抑制一水合氨电离,氢氧根离子浓度减小,所以$\frac{c(N{{H}_{4}}^{+})}{c(O{H}^{-})}$的值增大,故答案为:增大;
(4)NH3•H2O为弱电解质,不能完全电离,如等体积混合,溶液呈酸性,要呈中性氨水应过量,溶液为中性,则c(H+)=c(OH-),根据电荷守恒则c(NH4+)=c(Cl-(4),所以溶液中离子浓度由大到小的顺序是c(NH4+)=c(Cl-)>c(H+)=c(OH-);
故答案为:小于;c(NH4+)=c(Cl-)>c(H+)=c(OH-);
(5)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的$\frac{1}{10}$,为0.01mol/L,由Kw=c(OH-)•c(H+)可知,c(OH-)=10-12 mol•L-1,则此时溶液中由水电离出的c(H+)=10-12 mol•L-1,
故答案为:10-12.
点评 本题考查了离子浓度大小比较,根据溶液中的溶质及溶液酸碱性结合守恒思想分析解答,题目难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为-241.8 kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=a;2C(s)+O2(g)=2CO(g);△H=b,则a>b | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁丝在空气中被点燃,火星四射 | |
| B. | 氧化铁放入氢氧化钠溶液中,生成红褐色沉淀 | |
| C. | 点燃氢气和一氧化碳的混合气体,发生猛烈爆炸 | |
| D. | 氯化铜溶液中滴入氢氧化钠溶液,产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步骤 | 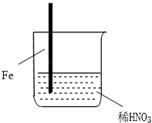 | 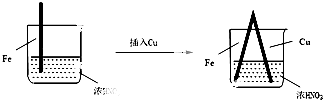 | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g Na在化学反应中失去的电子数目为NA | |
| B. | 17g NH3中所含原子数为4NA | |
| C. | 常温常压下,11.2 LSO3含有的氧原子数为1.5NA | |
| D. | 标准状况下,分子数目为NA氯气所占的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯、二甲苯等,因此可以通过煤的干馏得到,并将它们分离 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | 绿色化学的核心是利用化学原理治理环境污染 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有8个副族 | B. | 元素周期表有7个周期 | ||
| C. | 短周期是指第一、二周期 | D. | IA族的元素全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8kJ/mol | |
| D. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com