
| 物质的量/mol 时间 | n (N2H4) | n (NO2) | n (N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
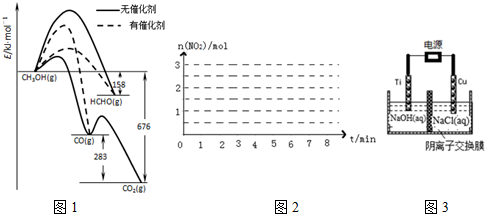
分析 (1)①根据图表可知HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)中反应物能量高,生成物能量低,该反应为放热反应,然后依据图中给出数据解答;
②使用催化剂可以降低反应的活化能,活化能越低,普通分子越容易转化成活化分子,反应越容易,反应速率越快;
(2)①a.混合气体密度保持不变,说明气体的质量不变,正逆反应速率相等;
b.速率之比等于对应物质的化学计量数之比,所以3v正(NO2)=2v正(N2);
c.因为起始时投料量之比为1:1,而且消耗量是1:1,所以N2H4与NO2体积比始终保持不变;
d.体系压强保持不变,说明气体的量保持不变.
②根据反应方程式2N2H4(g)+2NO2(g)?3N2(g)+4H2O,求abc的值然后根据描点法作图,根据三行式来求平衡常数;
(3)①根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
②在电解池的阳极发生失电子的氧化反应.
解答 解:(1)①HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)该反应为放热反应,△H=-(676-158-283)KJ•mol-1=-235KJ•mol-1,所以1moL HCHO生成CO的热化学方程式为:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-(676-158-283)KJ•mol-1=-235KJ•mol-1,
故答案为:HCHO(g)+$\frac{1}{2}$O2(g)═CO(g)+H2O(g)△H=-235KJ•mol-1;
②由图催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能,所以有催化剂作用下反应,产物中HCHO比率大大提高,故答案为:催化剂使生成HCHO的活化能降低,同时使生成CO的活化能升高,并且生成HCHO的活化能低于生成CO的活化能;
(2)①a.混合气体密度保持不变,说明气体的质量不变,正逆反应速率相等,达平衡状态,故正确;b.速率之比等于对应物质的化学计量数之比,所以3v正(NO2)=2v正(N2),达平衡状态,故正确;
c.因为起始时投料量之比为1:1,而且消耗量是1:1,所以N2H4与NO2体积比始终保持不变,故错误;
d.体系压强保持不变,说明气体的量保持不变,达平衡状态,故正确;
故选abd;
②根据反应方程式2N2H4(g)+2NO2(g)?3N2(g)+4H2O,第2min时,n(N2H4)=1.5mol,所以变化量为0.5mol,则a=2.5mol,由此可求出b=2.4mol,c=2,而使催化剂平衡不移动;升高温度平衡逆向移动,所以二氧化氮的浓度变大;增大压强,平衡正向移动,所以二氧化氮的浓度减小,所以图象为: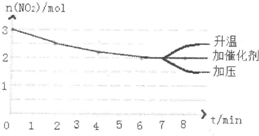 ;平衡常数K=$\frac{{c}^{3}({N}_{2})}{{c}^{2}({N}_{2}{H}_{4})•{c}^{2}(N{O}_{2})}$=$\frac{(\frac{1.5}{5})^{3}}{(\frac{1}{5})^{2}×(\frac{2}{5})^{2}}$=4.2L/mol,
;平衡常数K=$\frac{{c}^{3}({N}_{2})}{{c}^{2}({N}_{2}{H}_{4})•{c}^{2}(N{O}_{2})}$=$\frac{(\frac{1.5}{5})^{3}}{(\frac{1}{5})^{2}×(\frac{2}{5})^{2}}$=4.2L/mol,
故答案为: ;4.2L/mol;
;4.2L/mol;
(3)①根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O,故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;\;△\;\;}}{\;}$2Cu2O+N2↑+6H2O;
②在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,故答案为:2Cu-2e-+2OH-=Cu2O+H2O.
点评 本题考查了热化学方程式书写和平衡状态的判断、作图象的问题和化学平衡常数、化学方程式的书写以及电极反应式的书写,反应过程分析是解题关键,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
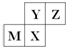
| A. | 四种元素中,最高价氧化物的水化物酸性:Z的最强 | |
| B. | 氢化物稳定性:Y的最强 | |
| C. | 原子半径由小到大顺序:Y<Z<M<X | |
| D. | 同周期元素中M元素原子失电子最多,其单质的还原性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 | 说明原溶液中一定含有FeCl3 |
| B | 白色Mg(OH)2 $\stackrel{CuSO_{4}溶液}{→}$蓝色Cu(OH)2 | Mg(OH)2的溶度积大于Cu(OH)2 |
| C | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2HaOH(足量)═Na2HPO2+2H2O | H3PO3属于三元酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (A-x+m)mol | B. | (A-x-m)mol | C. | $\frac{W}{A}$(A-x+m)mol | D. | $\frac{W}{A}$(A-x-m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的同分异构体中,一氯代物仅有一种的有机物一定是2,2一二甲基戊烷. | |
| B. | 若某高分子化合物对应的单体有两种,则此高聚物一定是通过缩聚反应得到的. | |
| C. | 等物质的量的乙烯和乙醇在足量氧气中完全燃烧,消耗O2和生成CO2的量相等 | |
| D. | 苯丙氨酸的结构为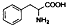 ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. ,分子式为C9H10NO2,它既能与酸反应又能与碱反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 As、N、0等非金属元素的化合物在工业生产中有重要的应用.
As、N、0等非金属元素的化合物在工业生产中有重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com