
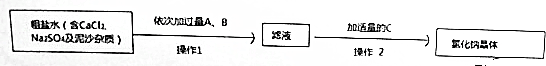
分析 (1)加过量的Ba(OH)2除去SO42-,加过量Na2CO3除去Ca2+和过量的Ba2+,加盐酸除去OH- 和CO32-,使溶液的溶质为NaCl;
(2)过滤除去CaCO3、BaSO4、BaCO3 沉淀,对氯化钠溶液进行蒸发浓缩、冷却结晶制得氯化钠晶体;
(3)过量的Ba(OH)2、Na2CO3淀是为了除去Ca2+、SO42- Ba2+杂质离子,方程式见答案;
(4)加稀盐酸是调节溶液pH,除去OH- 和CO32-,最终溶液为氯化钠溶液,呈中性,故可以用pH试纸测溶液pH接近7.
解答 解:(1)加过量的Ba(OH)2除去SO42-,加过量Na2CO3除去Ca2+和过量的Ba2+,加盐酸除去OH- 和CO32-,使溶液的溶质为NaCl,故答案为:Ba(OH)2、Na2CO3、稀盐酸;
(2)过滤除去CaCO3、BaSO4、BaCO3 沉淀,对氯化钠溶液进行蒸发浓缩、冷却结晶制得氯化钠晶体,故答案为:过滤、蒸发结晶;
(3)过量的Ba(OH)2、Na2CO3淀是为了除去Ca2+、SO42- Ba2+杂质离子,故答案为:Ba(OH)2+Na2SO4=BaSO4↓+2NaOH,Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,CaCl2+Na2CO3=CaCO3↓+2NaCl;
(4)加稀盐酸是调节溶液pH,除去OH- 和CO32-,最终溶液为氯化钠溶液,呈中性,故可以用pH试纸测溶液pH接近7,故答案为:用PH试纸测试溶液的pH呈中性.
点评 本题考查学生对粗盐提纯的基本方法,掌握分离提纯我的基本方法和操作,属于中等难度试题.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

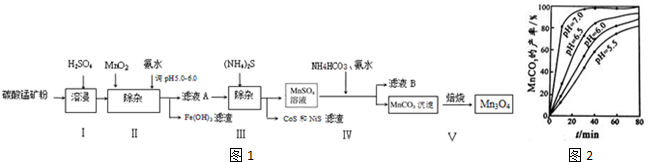
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步 骤 | 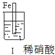 | 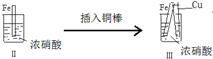 | |
| 现 象 | 铁表面产生大量无色气泡,液面上方变为红棕色 | 铁表面产生少量红棕色气泡后,迅速停止 | 铁、铜接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2→2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对III中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4++H2O?NH3•H2O+H+ | |
| B. | Al3++3H2O?Al(OH)3+3H+ | |
| C. | CH3COO-+NH4++H2O?CH3COOH+NH3•H2O | |
| D. | HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com