


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡溶液中滴加稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、在Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C、少量SO2用氨水吸收:2NH3?H2O+SO2═2NH4++SO32-+H2O |
| D、向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu粉反应:Cu+2Fe3+=Cu2++2Fe2+ | ||||
B、用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
| ||||
| C、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | ||||
| D、往氯化铝溶液中滴加过量的氢氧化钠溶液:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
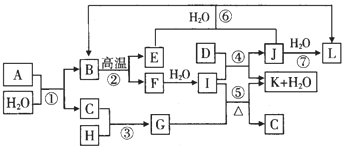
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如图.
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.80L |
| B、5.60L |
| C、11.2L |
| D、16.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L CCl4含有的分子数目为0.5NA |
| B、在常温常压下,1mol氦气所含原子数为2NA |
| C、10g重水(D2O)里含有的电子数为10NA |
| D、标准状况下,22.4L NO2气体含有的分子数目小于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com