尿素(H
2NCONH
2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位.
(1)工业上合成尿素的反应如下:2NH
3(l)+CO
2(g)?H
2O(l)+H
2NCONH
2(l)△H=-103.7kJ?mol
-1下列措施中有利于提高尿素的生成速率的是______
A.采用高温 B.采用高压
C.寻找更高效的催化剂 D.减小体系内CO
2浓度
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH
3(l)+CO
2(g)?H
2NCOONH
4(氨基甲酸铵)(l)△H
1第二步:H
2NCOONH
4(l)?H
2O(l)+H
2NCONH
2(l)△H
2.
某实验小组模拟工业上合成尿素的条件,在一体积为0.5L密闭容器中投入4mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:
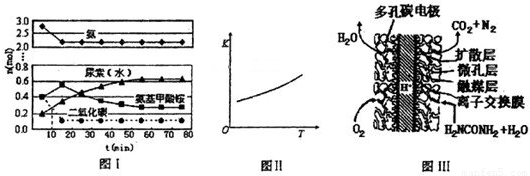
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡.
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H
2______0(填“>”“<”或“=”)
(3)在温度70-95℃时,工业尾气中的NO、NO
2可以用尿素溶液吸收,将其转化为N
2①尿素与NO、NO
2三者等物质的量反应,化学方程式为______.
②已知:N
2(g)+O
2(g)═2NO(g).△H=180.6kJ?mol
-1N
2(g)+3H
2(g)═2NH
3(g)△H=-92.4kJ?mol
-12H
2(g)+O
2(g)═2H
2O(g)△H=-483.6kJ?mol
-1则4NO(g)+4NH
3(g)+O
2(g)═4N
2(g)+6H
2O(g)△H=______kJ?mol
-1(4)尿素燃料电池结构如上图III所示.其工作时负极电极反应式可表示为______.




 阅读快车系列答案
阅读快车系列答案