
 铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:分析 (1)同一周期元素,元素电负性能随着原子序数增大而增大;Fe原子3d、4s能级电子为其价电子;
(2)熔沸点较低的晶体为分子晶体;Fe(CO)5在空气中燃烧后剩余的固体呈红棕色,为氧化铁,同时生成C的稳定氧化物二氧化碳;
(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式;该配体中Cu原子提供空轨道、N原子提供孤电子对;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有配位键和δ键生成;
(5)利用均摊法计算晶胞中Fe原子个数;根据密度公式ρ=$\frac{\frac{M}{{N}_{A}}×Fe原子个数}{V}$.
解答 解:(1)同一周期元素,元素电负性随着原子序数增大而增大,这三种元素第一电离能大小顺序是0>N>C;Fe原子3d、4s能级电子为其价电子,基态Fe原子的价电子排布式为3d64s2,
故答案为:0>N>C;3d64s2;
(2)熔沸点较低的晶体为分子晶体,Fe(CO)5又名羰基铁,常温下为黄色油状液体,其熔沸点较低,为分子晶体;Fe(CO)5在空气中燃烧后剩余的固体呈红棕色,为氧化铁,同时生成C的稳定氧化物二氧化碳,
反应方程式为4Fe(CO)5+13O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+20CO2,
故答案为:分子晶体;4Fe(CO)5+13O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+20CO2;
(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2,该配体中Cu原子提供空轨道、N原子提供孤电子对,
故答案为:sp3、sp2;N;
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,
故选bd;
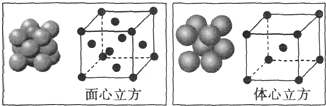
(5)利用均摊法计算晶胞中Fe原子个数,面心立方晶胞中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,所以二者Fe原子个数之比=4:2=2:1;
设Fe原子半径为rcm,面心立方晶胞半径=2$\sqrt{2}$rcm,其体积=(2$\sqrt{2}$rcm)3,
体心立方晶胞半径=$\frac{4\sqrt{3}}{3}$rcm,体积=($\frac{4\sqrt{3}}{3}$rcm)3,
其密度之比=$\frac{\frac{M}{{N}_{A}}×4}{(2\sqrt{2}rcm)^{3}}$:$\frac{\frac{M}{{N}_{A}}×2}{(\frac{4\sqrt{3}}{3}rcm)^{3}}$=4$\sqrt{2}$:3$\sqrt{3}$,
故答案为:2:1;4$\sqrt{2}$:3$\sqrt{3}$.
点评 本题考查晶胞计算,为高频考点,侧重考查学生分析计算及空间想象能力,涉及晶胞计算、原子杂化方式判断、元素周期律等知识点,难点是晶胞计算,注意Fe晶胞面心立方和体心立方区别,关键会正确计算两种晶胞体积,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子式分别为C2H6和C4H10的两种有机化合物一定互为同系物 | |
| B. | 某反应过程中的能量变化如图所示,可见催化剂能改变该反应的焓变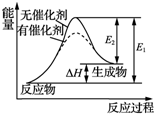 | |
| C. | 非金属氧化物一定是酸性氧化物 | |
| D. | 1 mol N2与3 mol H2在一定条件下充分反应可得2 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②⑤ | C. | ③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | HCl、HBr、HI | D. | SO2、CO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下0.46 mol气体 | |
| C. | 配制200 mL 4.6mol•L-1的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
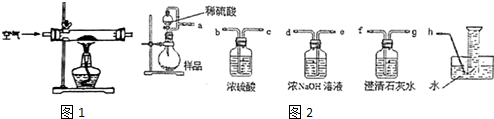
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com