
【题目】氮及其化合物与人类生产、生活密切相关。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36L CO时,放出的热量为___________kJ(用含有a和b的代数式表示)。
(2)在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[
N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[![]() (NO2)]与反应时间(t)的关系如下表:
(NO2)]与反应时间(t)的关系如下表:

①0~20 min内,v(N2O4)=________mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为_____________。改变温度至T1时k1=k2,则T1_________373K(填“>”、“<”或“=”)。
(3)连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7,Ka2=10-12)
①若V=100,则所得溶液中c(H2N2O2)_____________c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因____________________________________________________________。
②若V=200,则所得溶液中离子浓度由大到小的顺序为________________________。
【答案】 ![]() 或
或![]() 2.0×10-3 k1=60k2 > > 恰好完全反应生成NaHN2O2,Kh(HN2O2-)=
2.0×10-3 k1=60k2 > > 恰好完全反应生成NaHN2O2,Kh(HN2O2-)=![]() >Ka2=10-12,水解程度大于电离程度,因此溶液中c(H2N2O2)>c(N2O22-) c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)
>Ka2=10-12,水解程度大于电离程度,因此溶液中c(H2N2O2)>c(N2O22-) c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)
【解析】试题分析:(1)根据盖斯定律书写用CO还原NO2至N2的热化学方程式,再根据热化学方程式计算消耗标准状况下3.36L CO时放出的热量;(2) ①根据![]() 计算v(N2O4); ②先计算达到平衡时NO2、N2O4的浓度,再根据平衡时v(NO2):v(N2O4)=2:1计算k1、k2的数学关系式;(3) ①若V=100,溶液中的溶质是NaHN2O2;②若V=200,溶液中的溶质是Na2N2O2;
计算v(N2O4); ②先计算达到平衡时NO2、N2O4的浓度,再根据平衡时v(NO2):v(N2O4)=2:1计算k1、k2的数学关系式;(3) ①若V=100,溶液中的溶质是NaHN2O2;②若V=200,溶液中的溶质是Na2N2O2;
解析:(1) ①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0);②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0);根据盖斯定律①![]() ②得4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=(-2a-b) kJ·mol-1,标准状况下3.36L CO的物质的量是0.15mol,消耗标准状况下3.36L CO时放出的热量
②得4CO(g)+2NO2(g)=N2(g)+4CO2(g) △H=(-2a-b) kJ·mol-1,标准状况下3.36L CO的物质的量是0.15mol,消耗标准状况下3.36L CO时放出的热量![]() kJ;(2) ①设 0~20 min内生成N2O4的物质的量是xmol,
kJ;(2) ①设 0~20 min内生成N2O4的物质的量是xmol,
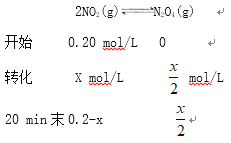
![]()
X=0.08mol,v(N2O4)= ![]() mol/L
mol/L ![]() = 2.0×10-3。
= 2.0×10-3。
②设平衡时N2O4的浓度x mol/L,
![]()
![]()
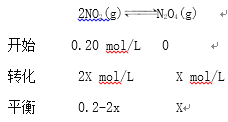
![]()
X=0.075 mol/L,v(NO2):v(N2O4)=2:1即k1·c2(NO2):k2·c(N2O4)=2:1,k1![]() 0.0025:k2
0.0025:k2![]() 0.075=2:1,所以k1=60k2。若改变温度至T1时k1=k2,则正反应速率小于逆反应速率,平衡逆向移动,该反应的正反应放热,所以T1>373K;(3) ①若V=100,溶液中的溶质是NaHN2O2,HN2O2-的电离平衡常数是10-12,水解平衡常数是
0.075=2:1,所以k1=60k2。若改变温度至T1时k1=k2,则正反应速率小于逆反应速率,平衡逆向移动,该反应的正反应放热,所以T1>373K;(3) ①若V=100,溶液中的溶质是NaHN2O2,HN2O2-的电离平衡常数是10-12,水解平衡常数是![]() ,水解大于电离,所以 c(H2N2O2)>c(N2O22-);②若V=200,溶液中的溶质是Na2N2O2,N2O22-发生两步水解反应,所以所得溶液中离子浓度由大到小的顺序为c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)。
,水解大于电离,所以 c(H2N2O2)>c(N2O22-);②若V=200,溶液中的溶质是Na2N2O2,N2O22-发生两步水解反应,所以所得溶液中离子浓度由大到小的顺序为c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】为測定某工业碱(组成为xNa2CO3·yNaHCO3)中Na2CO3的貭量分數,甲、乙、丙三名同学分別设计并完成了如下实验:
甲同学:准备称取11.40g样品利用图中装置迸行实验,反应后測定装置C中碱石灰増重5.06g。
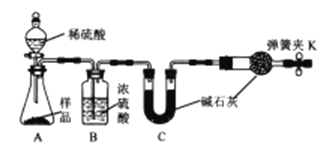
乙同学:准确称取11.40g研细的样品,加热样品至固体完全分解,剩余固体质量为9.54g.
丙同学:准确称取11.40g样品,配成1000mL溶液,量取25.00mL溶液于锥形瓶中,加入指示剂,用0.1500mol/L标准盐酸溶被滴定至终点。完成三次平行实验后,消耗盐酸的体积平均为30.00mL。
(1)如何检查甲同学实验装置的气密性?_______________。
(2)①乙同学需要在______(填仪器名称,下同)将样品研细,在______中加热样品;
②乙同学在实验时需要将固体加热一段时间然后冷却,称量,再加热、冷却、称量,直至最后两次称量的质量差不超过0.10g,其目的是___________ 。
(3)丙同学在实验之前为了确定晶体中是否含有NaHCO3,设计了以下实验方案进行检验。
实验步骤:取少量样品于锥形瓶中加入适量蒸馏水使之溶解,加入几滴酚酞,用0.100mol/L盐酸滴定至溶液由浅红色变无色,记录消耗盐酸的体积为V1;______(填实验操作),记录消耗盐酸的体积为V2,若V2_____V1(填“<、>或=”),说明晶体中含有NaHCO3.
(4)请分析、计算后回答。
①_____同学实验结果错误,其实验失败的原因是___________。
②晶体中Na2CO3的质量分数为____________。(计算结果保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用越来越受到人们的关注。
(1)基态Ti原子核外电子排布的最高能级符号是________。与钛同周期元素中,基态原子的未成对电子数与钛相同的有_______种。
(2)钛比钢轻,比铝硬,是种新兴的结构材料。钛硬度比铝大的原因是_________
(3)催化剂M能催化乙烯、丙烯、米乙烯等的聚合,其结构如图所示。
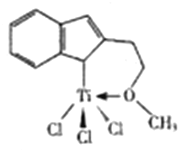
①M中,碳原子的杂化形式有__________种。
②M中,不含___________(填标号)。
a.π键 b.σ键 c.配位键 d.氢键 e.离子健
(4)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
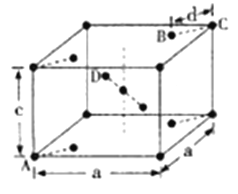
①4个微粒A、B、C、D中,属于氧原子的是______
②若A、B、C的原子坐标分别为A(0,0,0)、(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,___________,_____________);钛氧键键长d=_________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是

A.②和④处 B.只有②处 C.②和③处 D.②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P-P:a kJ·mol-1、P—O:b kJ·mol-1、P===O:c kJ·mol-1、O===O:d kJ·mol-1。根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国学者研制了一种纳米反应器用于催化草酸二甲酯(DMO)和氢气反应获得EG.反应过程示意图如下:÷
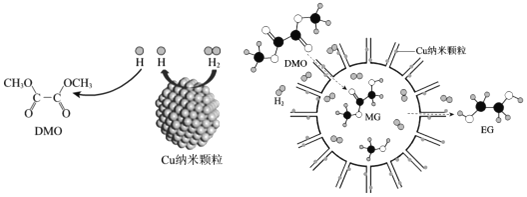
下列说法不正确的是
A. Cu纳米颗粒将氢分子解离成氢原子
B. DMO分子中只有碳氧单键发生了断裂
C. 反应过程中生成了EG和甲醇
D. EG和甲醇不是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温密闭容器发生可逆反应:Z(?)+W(?)![]() X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是
X(g)+Y(?);△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后不再改变条件。下列有关说法中正确的是

A. Z和W在该条件下有一种可能为气态
B. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等。
C. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
D. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子最外层电子排布式为nsnnpn+1。试解答下列各题:
(1)电子排布式中的n=________;原子中能量最高的是________电子,其电子云在空间有______________________方向,原子轨道呈现________形。
(2)元素X的名称是________;它的氢化物的电子式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com