
| 50g |
| 100g/mol |


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
| A、原子半径:W>Y>Z,而离子半径:Z>Y>W |
| B、甲沸点远高于乙,可能是甲分子间存在氢键所致 |
| C、测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 |
| D、W的氯化物水溶液中通入YX3至过量,现象是先有白色沉淀,后逐渐溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18gH2O含有10 NA个质子 |
| B、1mol己烷含有18NA个化学键 |
| C、22.4L氨水含有NA个NH3分子 |
| D、56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2厂生成CH3OH:CO2(g)+3H2(g)
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2厂生成CH3OH:CO2(g)+3H2(g)
| ||
| A、在前3分钟内v(H2)=10molL-1min-1 |
| B、在3分钟时CO2和CH3OH浓度相等,反应达到平衡 |
| C、在前15分钟内平衡常数K随CO2减少而逐渐减小 |
| D、在前15分钟时向设备中充入CO2和H2各10mol以提高H2转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
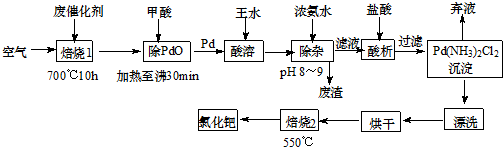
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaA溶液中c(Na+)-c(A-)=10-6mol?L-1 |
| B、NaB溶液中c(H+)+c(HB)=10-2mol?L-1 |
| C、将两溶液混合,混合溶液中:c(OH-)>5×10-3mol?L-1 |
| D、两溶液中的离子总数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
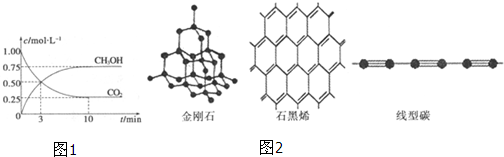
查看答案和解析>>
科目:高中化学 来源: 题型:
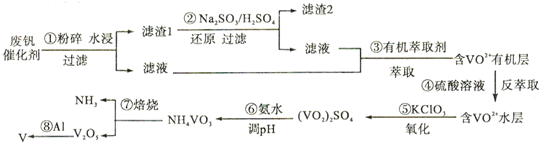
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com