
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验反应得到的混合气体中含有SO2、H2、H2O
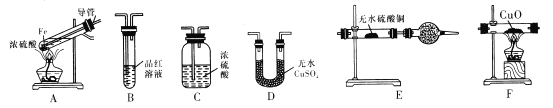
己知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________。
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→______(不可重复使用)。
(3)A中导管的作用为______,装置E中的干燥管中盛放的物质为碱石灰,其作用是________。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:
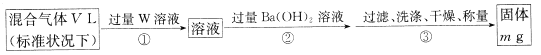
(5) W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为_______(用含V、m的代数式表示)。
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为______(用含V、c、x的代数式表示)[已知:I2+2S2O32-=2I-+S4O62-]。
【答案】 2Fe+3H2SO4===2FeSO4+SO2+H2+2H2O D→B→C→F→E 安全管,平衡气压 防止空气中的水分干扰实验,吸收多余的SO2 F中黑色固体粉末变为红色,E中无水硫酸铜变蓝 AD ![]()
![]()
【解析】(1)根据原子守恒可知过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式为2Fe+3H2SO4=2FeSO4+SO2↑+H2↑+2H2O。(2)由于通过溶液会带出水蒸气,首先检验水蒸气,利用品红溶液检验SO2,氢气和氧化铜反应之前还需要干燥氢气,且SO2有毒、还需要防止空气中水蒸气,所以若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→D→B→C→F→E。(3)反应中产生气体,因此A中导管的作用为安全管,平衡气压;装置E中的干燥管中盛放的物质为碱石灰,其作用是防止空气中的水分干扰实验,吸收多余的SO2。(4)氢气还原氧化铜生成铜和氢气,则证明有H2存在的实验现象是F中黑色固体粉末变为红色,E中无水硫酸铜变蓝。(5) 由于亚硫酸钡不稳定,因此应该转化为硫酸钡,所以W应该具有氧化性,能把SO2氧化,且不能引入硫酸根,所以选择双氧水或氯水,答案选AD。硫酸钡是mg,则根据硫原子守恒可知SO2是![]() ,所以该混合气体中二氧化硫的体积分数为
,所以该混合气体中二氧化硫的体积分数为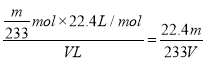 。(6)根据方程式I2+SO2+2H2O=H2SO4+2HI、I2+2S2O32-=2I-+S4O62-可知该混合气体中二氧化硫的体积分数为
。(6)根据方程式I2+SO2+2H2O=H2SO4+2HI、I2+2S2O32-=2I-+S4O62-可知该混合气体中二氧化硫的体积分数为![]() 。
。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】能用H++OH﹣=H2O表示的是( )
A.NaOH溶液和CO2的反应
B.Cu(OH)2和稀H2SO4的反应
C.Ba(OH)2溶液和盐酸反应
D.CaCO3和稀H2SO4的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液,滴加过程中溶液中-lgc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )

A. z点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为y点
C. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
D. Ksp(CaCO3)=5×10-10mol2/L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去)。A、C是常见的金属单质,B是黑色有磁性的氧化物,X是黄绿色气体,Y是常见的酸,Z是常见的碱,其焰色反应显黄色。反应①需在高温下进行。

请回答下列问题:
(1) Z的电子式为________。
(2) G的化学式为________。
(3) 写出①的化学方程式:________。
(4) 写出I转化为J的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备化肥X和Mn3O4的工艺流程如下:
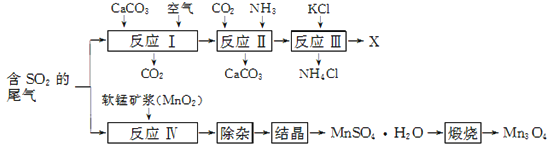
请回答下列问题:
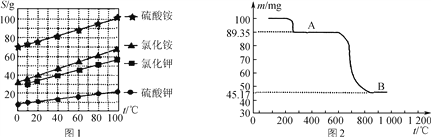
(1) 几种盐的溶解度见下如图。化肥X的化学式为________;为获得固体X,加入KCl溶液后需对混合溶液进行蒸发浓缩,当析出大量晶体后,应________(填操作名称),再洗涤、干燥晶体。
(2) 检验X样品是否含有氯化物杂质的实验操作是________。
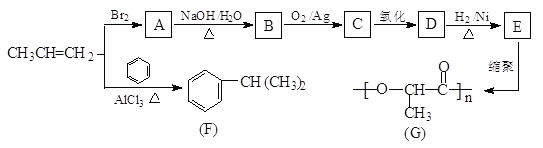
(3) 如图是隔绝空气条件煅烧MnSO4·H2O时剩余固体质量与温度的变化曲线,请写出A→B的化学方程式:____________________。
(4) 为了测定产品中Mn3O4的纯度,取2.500 g样品与浓盐酸共热(杂质不与盐酸反应),将产生的气体通入足量淀粉碘化钾溶液中,稀释至250 mL,从中取25.00 mL用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点时,消耗20.00 mL标准溶液(2Na2S2O3 +I2===2NaI+Na2S4O6)。
① 样品与浓盐酸发生反应的离子方程式为________。
② 该样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.碳酸钠溶液显碱性,是因为溶液中c(OH﹣)>c(H+)
D.NaHCO3溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
完成下列填空:
(1)F的分子式为_______________,化合物E中所含两个官能团的名称是____、______。
(2)写出反应类型:丙烯直接形成高分子______;A→B____________。
(3)B转化为C的化学方程式为____________。
(4)E的一种同分异构体M具有如下性质:①能发生银镜反应;②1molM与足量的金属钠反应可产生lmolH2,则M的结构简式为____________。
(5)写出由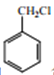 合成
合成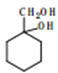 的合成路线________。
的合成路线________。
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com