
| A. | ①②④ | B. | ①②③ | C. | ①②③⑤ | D. | 全部正确 |
分析 设CO和CO2的物质的量为1mol,然后结合二者分子组成根据n=nNA进行计算.
解答 解:①根据n=nNA可知二者所含分子数相等,含有分子数目之比为1:1,故①正确;
②它们所含的O原子数目之比等于含有O的物质的量之比=(1×1):(1×2)=1:2,故②正确;
③它们所含的原子数目之比等于含有原子的物质的量之比=(1×2):(1×3)=2:3,故③正确;
④它们所含的C原子数目之比等于含有C的物质的量之比=(1×1):(1×1)=1:1,故④正确;
⑤它们所含的电子数目之比等于含有电子的物质的量之比=(1×14):(1×22)=7:11,故⑤正确;
故选D.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与其它物理量之间的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 1×10-17 | 8×10-16 | 4×10-38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “血液透析”利用了胶体的性质 | |
| B. | 溶液是电中性的,胶体是带电的 | |
| C. | 一束光线分别通过溶液和胶体时,前者会出现明显的光带,后者则没有 | |
| D. | 浓NaOH溶液中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向Ba(OH)2溶液中加入H2SO4溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向Na2CO3溶液中加入少量稀H2SO4溶液:CO32-+2H+═CO2↑+H2O | |
| D. | 过量的铁与稀HNO3反应:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
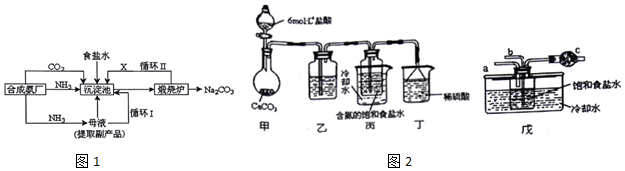
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | |
| C | D |
| A. | 阴离子半径从大到小的排列顺序为:C>D>B | |
| B. | B元素的两种同素异形体常温下都是气体 | |
| C. | 最高价氧化物对应的水化物的酸性:D>C | |
| D. | B元素的氢化物的沸点低于C元素的氢化物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
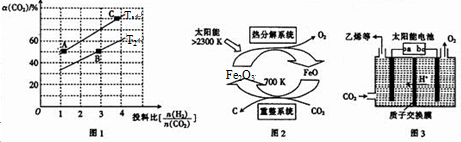
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com