
【题目】稀土铈(Ce)元素主要存在于独居石中,金属铈化学性质十分活泼。近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<![]() <2,下列说法不正确的是
<2,下列说法不正确的是

A.CeO2是水分解的催化剂
B.T<1050℃时,CeO2比CeO2—δ稳定
C.工业上可用电解CeCl4溶液制备Ce
D.过程②的方程式为CeO 2—δ+δH2O![]() CeO2+δH2
CeO2+δH2
科目:高中化学 来源: 题型:
【题目】某化学实验小组欲制备三草酸合铁(Ⅲ)酸钾并用离子交换法测定其配离子的电荷,实验过程如下:
Ⅰ.三草酸合铁(Ⅲ)酸钾的制备
①称取![]() ,加数滴
,加数滴![]() ,另称取
,另称取![]() ,分别以蒸馏水溶解,将两溶液缓慢混合并加热至沸,搅拌并维持微沸约
,分别以蒸馏水溶解,将两溶液缓慢混合并加热至沸,搅拌并维持微沸约![]() 后停止加热,此时有
后停止加热,此时有![]() 晶体产生,待充分沉降后过滤,以热蒸馏水洗涤沉淀。
晶体产生,待充分沉降后过滤,以热蒸馏水洗涤沉淀。
②称取![]() ,加
,加![]() 蒸馏水,微热使其溶解,将该溶液加至已洗净的
蒸馏水,微热使其溶解,将该溶液加至已洗净的![]() 中,将盛该混合物的容器置于40℃热水中,以滴管缓慢加入约
中,将盛该混合物的容器置于40℃热水中,以滴管缓慢加入约![]() ,边加边搅拌,加完后,需检验
,边加边搅拌,加完后,需检验![]() 是否氧化彻底。
是否氧化彻底。
③在生成![]() 的同时也有
的同时也有![]() 生成,需在微沸情况下补加
生成,需在微沸情况下补加![]() 溶液,将其进一步转化为
溶液,将其进一步转化为![]() 。向所得绿色溶液中加入
。向所得绿色溶液中加入![]() 乙醇,将一小段棉线悬挂在溶液中,一端固定好,盖好烧杯,暗处放置数小时,即有
乙醇,将一小段棉线悬挂在溶液中,一端固定好,盖好烧杯,暗处放置数小时,即有![]() 析出,抽滤,向晶体上滴加少许乙醇,继续抽干,转移至表面皿上,低温干燥
析出,抽滤,向晶体上滴加少许乙醇,继续抽干,转移至表面皿上,低温干燥![]() ,称重,计算产率。
,称重,计算产率。
回答下列问题:
(1)步骤①中加硫酸的作用是___________,如何证明沉淀已洗净________________________。
(2)步骤②中,检验![]() 所用的试剂是______________,不能用酸性
所用的试剂是______________,不能用酸性![]() 溶液检验的理由是_____________________。
溶液检验的理由是_____________________。
(3)写出步骤③中![]() 转化为
转化为![]() 的化学反应方程式_____________。
的化学反应方程式_____________。
Ⅱ.离子交换法测定三草酸合铁(Ⅲ)酸钾中配离子的电荷
原理:利用离子交换树脂对某些离子具有特别的亲和力,当含有这些离子的溶液流过交换树脂时,会吸附在树脂上,树脂上原有的另一类同种电性离子会被溶液带出,从而实现离子的完全交换。
实验步骤:将准确质量的样品溶于水后,使其完全通过![]() 型离子交换树脂,样品中配离子即与氯离子实现交换。
型离子交换树脂,样品中配离子即与氯离子实现交换。
(4)若流出的交换液中![]() ,被交换配离子n(配离子)
,被交换配离子n(配离子)![]() ,则该配离子的负电荷数为___________________。
,则该配离子的负电荷数为___________________。
(5)以沉淀滴定法测定![]() :将流出液稀释至
:将流出液稀释至![]() ,取
,取![]() ,以
,以![]() 为指示剂,用
为指示剂,用![]() 标准溶液滴定至终点,消耗标准溶液
标准溶液滴定至终点,消耗标准溶液![]() 。
。
①溶解度![]() ________
________![]() (填“大于”或“小于”)。
(填“大于”或“小于”)。
②若离子交换步骤称取的样品物质的量为![]() ,该样品中配离子所带的负电荷数为______________。
,该样品中配离子所带的负电荷数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4是两种主要的温室气体。以CH4和CO2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。
已知:①CH3OH(g) + 3/2 O2(g) = CO2(g) + 2H2O(l) H1= a kJ/mol②H2(g) + 1/2 O2(g) = H2O(l) H2= b kJ/mol ③H2O(g) = H2O(l) H3= c kJ/mol,则CO2和H2反应生成CH3OH和水蒸气的热化学方程式为_____。
(2)用Cu2Al2O4作催化剂制备乙酸。已知:CO2(g)+CH4(g)![]() CH3COOH(g) H2=akJ/mol。
CH3COOH(g) H2=akJ/mol。
①各物质相对能量大小如图所示,则a=___。
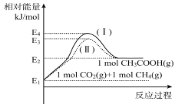
②该反应的速率方程可表示为:v(正)=k正c(CO2)c(CH4)和v(逆)=k逆c(CH3COOH),k正和k逆在一定温度时为常数,分别称作正,逆反应速率常数,请写出用k正,k逆表示的平衡常数的表达式K=___。
(3)将CO2和CH4在一定条件下反应可制得工业合成气,在1 L 密闭容器中通入CH4与CO2,使其物质的量浓度为1.0 mol/L,在一定条件下发生反应:CH4(g) + CO2(g) 2CO(g) + 2H2(g),测得CH4的平衡转化率与温度及压强的关系如下图所示:
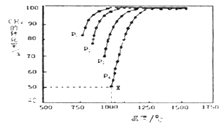
则:
①压强P1,P2,P3,P4由大到小的关系为___。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),如果P4=2 MPa,求x点的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列措施中能使平衡体系中c(CO)/c(CO2)减小的是__。
A.升高温度 B.增大压强
C.保持温度、压强不变,充入He D.恒温、恒容,再充入1 mol CO2和1 mol CH4
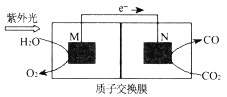
(4)科学家还研究了其他转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,N___极的电极反应式为______,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为___mol,N极电解质溶液m=__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
4NO2(g)+O2(g) ΔH >0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表,下列说法正确的是
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol·L-1 | 5.00 | 3.50 | 2.50 | 2.50 |
A. 500 s内NO2的生成速率为3.00×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时N2O5的转化率为50%
C. 达平衡后其他条件不变,将容器体积压缩到原来的![]() ,c(N2O5)<5.00 mol·L-1
,c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g),已达到平衡状态的是( )
C(g)+D(g),已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧B. ①③④⑤
C. ①②③④⑤⑦D. ①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、F、Cu及其化合物在化工、医药、材料等方面应用十分广泛。回答下列有关问题:
(1)N原子中最高能级的电子的电子云轮廓图为___________;基态Cu+的核外电子排布式为____________。
(2)化合物(CH3)3N可用于制备医药、农药。分子中N原子杂化方式为________,该物质能溶于水的原因是_____________________。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,其阳离子的空间构型为_____________,写出一种与[H2F]+互为等电子体的分子______________(写化学式)。
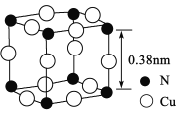
(4)氮、铜形成的一种化合物的晶胞结构如图所示。与每个Cu原子紧邻的Cu原子有____个,令阿伏加德罗常数的值为NA,该晶体的密度为______g/cm3。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用钛精矿(主要成分TiO2,矿粉中含有Fe,Al,Si,V等氧化物)制备海绵钛的基本思路是:氯化法生产TiCl4、还原、真空蒸馏法制备海绵钛(Ti)。
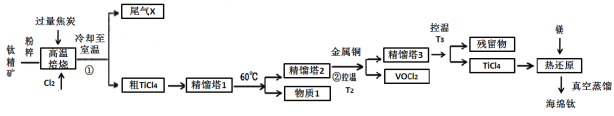
已知:①氯化过程中,其他元素均转化为最高价氯化物;
②热还原过程中,可能会有副产物TiCl3;
③常见物质熔沸点
化合物 | TiCl4 | SiCl4 | FeCl3 | AlCl3 | VOCl3 | VOCl2 | MgCl2 | Ti | Mg |
沸点 | 136 | 56 | 308 | 180(升华) | 134 | 168 | 1412 | 3260 | 1090 |
熔点 | -69 | -25 | 304 | 190 | -78.9 | —— | 712 | 1668 | 648.9 |
回答下列问题:
(1)将钛精矿粉粹的目的是:_______________
(2)氯化过程中,TiO2发生的化学方程式①是:_____________
(3)物质1是________,步骤②中金属铜的作用是将VOCl3还原成VOCl2,其目的是_____________;
(4)工业上常用Mg或H2作还原剂,在Ar气氛下采用热还原法制海绵钛。
①镁不足时,TiCl4会因有副产物产生而导致产率会下降,副反应的化学方程式为_____________;此处采用真空蒸馏法除去海绵钛中的Mg和MgCl2,不采用常压蒸馏的原因是_______。
②根据图象,计算1173K时,反应2H2+TiCl4 =Ti+4HCl的△G=_________。
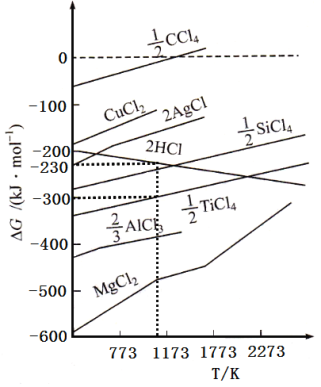
(G为自由能,图中△G是指在一定温度下,由单质生成对应物质的量化合物时的自由能变化。设此温度下,单质的生成自由能变化为0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验(a、b电极均为Ag单质),观察到了灵敏电流计指针发生偏转。下列说法正确的是
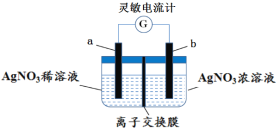
A.b极电极反应式为Ag–e–= Ag+
B.离子交换膜为阴离子交换膜
C.去掉离子交换膜,电流表仍然有电流通过
D.电流计指针不再偏转时,右边硝酸银溶液的物质的量浓度依然大于左边
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的说法正确的是
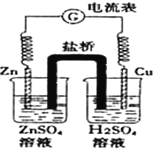
A. 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降
B. 盐桥的作用是让电子通过,以构成闭合回路
C. 随着反应进行,右烧杯中溶液pH变小
D. 总反应为:2H++ Zn ="==" H2↑+ Zn2+△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com