
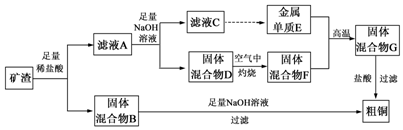
分析 工业矿渣中主要含有Cu2O,还有少部分Al2O3、Fe2O3、SiO2,加入足量的稀盐酸,Cu2O与盐酸反应生成Cu、CuCl2和水,Al2O3与盐酸反应生成AlCl3和水,Fe2O3与盐酸反应生成FeCl3和水,SiO2难溶于水,且不与水反应,且发生2FeCl3+Cu=2FeCl2+CuCl2,所以滤液A为CuCl2、AlCl3和FeCl2的混合物,得到的固体混合物B中有Cu和SiO2,固体混合物B与足量NaOH溶液混合,SiO2和NaOH溶液反应生成Na2SiO3和水,Cu与NaOH溶液不反应,得到粗铜,滤液A与足量NaOH溶液反应,CuCl2与NaOH反应生成Cu(OH)2 和水,FeCl2与NaOH溶液反应生成Fe(OH)2 白色沉淀,该沉淀在空气中与氧气反应生成Fe(OH)3,AlCl3与过量NaOH溶液反应生成NaAlO2和水,滤液C为NaAlO2溶液,经过一系列反应得到金属Al,固体混合物D为Cu(OH)2和Fe(OH)3,在空气中灼烧,Cu(OH)2和Fe(OH)3受热分解生成Fe2O3和CuO,所以固体混合物F为Fe2O3和Cu的混合物,该混合物与Al发生铝热反应,生成Fe和Cu,固体混合物G为Fe和Cu,与盐酸混合,Fe与盐酸反应生成FeCl2和氢气,Cu与盐酸不反应,过滤成为粗铜,以此解答该题.
解答 解:(1)固体混合物B与氢氧化钠溶液反应的化学方程式为SiO2+2NaOH═Na2SiO3+H2O,故答案为:SiO2+2NaOH═Na2SiO3+H2O;
(2)滤液A中铁元素的存在形式只能为Fe2+,理由是Fe2O3与盐酸反应后生成的Fe3+与过量铜单质反应后,全部转化为Fe2+,涉及的离子方程式为Fe2O3+6H+═2Fe3++3H2O; Cu+2Fe3+═Cu2++2Fe2+;检验滤液A中Fe2+的方法是取少量溶液于试管中,加入硫氰化钾溶液,无现象,在加热新制氯水,溶液变成血红色,则滤液中含有Fe2+,所以试剂为硫氰化钾溶液和新制氯水,
故答案为:Fe2O3+6H+═2Fe3++3H2O; Cu+2Fe3+═Cu2++2Fe2+;硫氰化钾溶液和新制氯水;
(3)氢氧化铝溶于强酸和强碱,所以将可溶性铝盐中的铝元素以沉淀形式析出,需加入弱酸,选D,
故答案为:D.
点评 本题考查物质分离和提纯及物质制备,为高频考点,侧重考查学生分析推断及知识综合应用能力,明确流程图中各物质成分及发生的反应、基本操作是解本题关键,熟练掌握常见离子、物质性质,知道铁离子、亚铁离子的检验方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | SO2(HCl)通过饱和Na2SO3溶液 | |
| B. | Na2CO3溶液(NaHCO3)滴加足量BaCl2溶液 | |
| C. | H2(H2S)通过CuSO4溶液 | |
| D. | Na2SO4溶液(Na2SO3)滴加足量HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
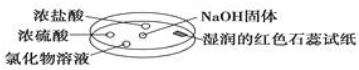 如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )
如图利用培养皿探究氨气的性质.实验时向NaOH固体上滴几滴浓氨水,立即用另一培养皿扣在上面.表中对实验现象所做的解释正确的是( )| 选项 | 实验现象 | 解释 |
| A | 浓盐酸附近产生白烟 | NH3与挥发出来的HCl气体反应生成了NH4Cl固体 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
| D | 湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z 的单质,q是元素X的单质,s是元素Y的单质且常温下为淡黄色固体,m与r相遇会产生白烟.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z 的单质,q是元素X的单质,s是元素Y的单质且常温下为淡黄色固体,m与r相遇会产生白烟.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 单质沸点:W>X>Z | |
| B. | 原子半径:Y>Z>W | |
| C. | Y的氧化物对应的水化物酸性一定比Z的弱 | |
| D. | W、X、Z三种元素组成的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 673K,30MPa下,在密闭容器中充入一定量的X、Y.发生反应;X(g)+2Y(g)?2Z(g),n(Z)和n(X)随时间变化如图.下列叙述正确的是( )
673K,30MPa下,在密闭容器中充入一定量的X、Y.发生反应;X(g)+2Y(g)?2Z(g),n(Z)和n(X)随时间变化如图.下列叙述正确的是( )| A. | c点的正反应速率与逆反应速率相等 | |
| B. | d点和e点的n(Z)不相等 | |
| C. | d点的反应速大于e点的反应速率 | |
| D. | 其他条件不变.将容器容积缩小到一半.反应至t1时刻.c(Y)比图中的d点大. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (m-1.6)g | B. | (m-2.4)g | C. | (m-3.2)g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 通入大大过量的空气使燃料充分燃烧,从而达到充分利用热能的目的 | |
| C. | 燃料的化学能可以在不同的条件下转化为热能、电能被人类利用 | |
| D. | 甲烷是比较洁净的燃料,标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程 式可表示为 CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
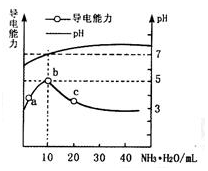 常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )
常温下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的NH3•H2O溶液,所得溶液pH及导电能力变化如图.下列分析不正确的是( )| A. | a~b点导电能力增强,说明HR为弱酸 | B. | b点溶液pH=7,此时酸碱恰好中和 | ||
| C. | c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | D. | b、c两点水的电离程度:b<c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com