
【题目】碳的化合物与人类生产、生活密切相关。
(1)标准状况下,将11.2LCO2通入100mL 1mol/L的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为___________;用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+______。
②c(H+)+c(Na+)=_________。
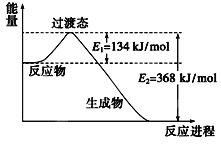
(2)下图是1mol NO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________
(3)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),
Ni(CO)4(g),![]() H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________(填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是________(填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,![]() H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(4)二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×105Pa测定):
①CH3OCH3(g)+H2O(l)![]() 2CH3OH(l)△H=+24.52kJ/mol
2CH3OH(l)△H=+24.52kJ/mol
②CH3OH(l)+H2O(l)![]() CO2(g)+3H2(g)△H=+49.01kJ/mol
CO2(g)+3H2(g)△H=+49.01kJ/mol
③CO(g)+H2O(l)![]() CO2(g)+H2(g)△H=-41.17kJ/mol
CO2(g)+H2(g)△H=-41.17kJ/mol
④CH3OH(l)![]() CO(g)+2H2(g)△H=+90.1kJ/mol
CO(g)+2H2(g)△H=+90.1kJ/mol
工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,
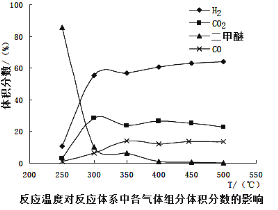
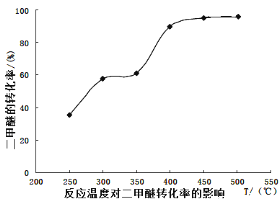
①你认为反应控制的最佳温度应为___________。
A.300~350℃B.350~400℃C.400~450℃D.450~500℃
②在温度达到400℃以后,二甲醚与CO2以几乎相同的变化趋势明显降低,而CO、H2体积分数也以几乎相同的变化趋势升高,分析可能的原因是___________(用相应的化学方程式表示)。
【答案】 c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+) c(H+)+c(HCO-3) 2c(CO2-3)+c(HCO-3)+c(OH-) NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol-1 C C 可能发生另一种重整制氢反应:CH3OCH3 +CO2 ![]() 3H2+3CO
3H2+3CO
【解析】(1)标准状况下,1.12L CO2的物质的量为:![]() =0.05mol,氢氧化钠的物质的量为:1molL-1×0.1L=0.1mol,二者恰好完全反应生成碳酸钠,由CO32-+H2OHCO3-+OH-可知:c(Na+)最大,水解很微弱,因此c(CO32-)>c(OH-)>c(HCO-3),溶液显碱性c(H+)最小,因此碳酸钠溶液中离子浓度大小顺序为:c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+);
=0.05mol,氢氧化钠的物质的量为:1molL-1×0.1L=0.1mol,二者恰好完全反应生成碳酸钠,由CO32-+H2OHCO3-+OH-可知:c(Na+)最大,水解很微弱,因此c(CO32-)>c(OH-)>c(HCO-3),溶液显碱性c(H+)最小,因此碳酸钠溶液中离子浓度大小顺序为:c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+);
①碳酸钠溶液中,水电离出的氢离子部分与CO32-结合生成H2CO3和HCO3-,溶液中质子守恒:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+);
②碳酸钠溶液中,电荷守恒:c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-);
(2)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJmol-1;
(3)A.Ni是固体,浓度为常数,改变用量对平衡无影响,反应物的转化率不变,故A错误;B.一定温度下给定的化学方程式的△H不会随着平衡移动而改变,只与方程式的书写方式有关,故B错误;C.因外界条件为恒温恒容、Ni是固体且正反应为气体体积缩小的反应,所以反应达到平衡后充入CO,相当于在恒温恒压条件下达平衡后又加压,平衡右移,CO的转化率提高,平衡后其体积分数降低,故C正确;D.速率关系未说明正、逆,不能判断是否已达平衡;因该反应气体质量增加而容积不变,所以混合气体密度是一个变量,当不变时说明反应达平衡,故D错误;故答案为C;
(4)①由图可知在400-450℃时,二甲醚的浓度最小,转化率最大,故答案为C;
②温度超过400℃,二甲醚与二氧化碳相同的比例降低,CO与氢气相同的比例升高,说明二甲醚与二氧化碳以1:1反应,生成CO与氢气的比例相同,则反应的方程式为:CH3OCH3+CO2![]() 3H2+3CO。
3H2+3CO。


科目:高中化学 来源: 题型:
【题目】下列物质中,既能因发生化学反应而使溴水褪色,又能使高锰酸钾酸性溶液褪色的是( )
①CH3CH2CH2CH3 ②CH3CH2CH===CH2

A.①②③④ B.②③④
C.②④ D.只有②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH均为9的CH3COONa溶液和KCN溶液,它们的物质的量浓度关系正确的是
A. c(CH3COONa) > c(KCN) B. c(CH3COONa) < c(KCN)
C. c(CH3COONa) = c(KCN) D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为____________。
(2)锗、砷、硒的第一电离能大小排序为____________。H2SeO4的酸性比H2SeO3的强,其原因是__________。
(3)H2SeO3的中心原子杂化类型是_______;SeO32-的立体构型________。
(4)H2Se属于____________ (填“极性”或“非极性”)分子;单质Se的熔点为217℃,它属于_________晶体。
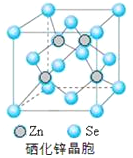
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为_________;若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg/mol。NA代表阿伏加德罗常数,则晶胞参数a为__________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A. 水中的钢闸门连接电源的负极 B. 金属护栏表面涂漆
C. 汽水底盘喷涂高分子膜 D. 地下钢管连接镁块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
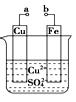
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-==Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的反应:2SO2(g) + O2(g) ![]() 2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
A. 正、逆反应速率都等于零 B. SO2、O2、SO3的浓度相等
C. SO2、O2、SO3在容器中共存 D. SO2、O2、SO3的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
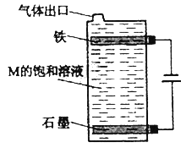
【题目】甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题:
(1)戊离子的结构示意图为________。
(2)写出乙的单质的电子式:________。
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2∶4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:____________。
(5)按图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com