
【题目】下列实验装置、操作正确,且能实现相应实验目的的是:
实验装置 | 实验操作 | 实验目的 | |
A |
| 用标准KMNO4溶液滴定Na2S2O3溶液 | 测定Na2S2O3溶液浓度 |
B |
| 蒸发AlCl3溶液 | 得到AlCl3固体 |
C |
| 逐滴滴加 AgNO3 溶液 | 根据沉淀产生的先后顺序确定Ksp(A gCl)和Ksp(AgI)的大小 |
D |
| 加热 NH4Cl 固体 | 制备 NH3 |
A.AB.BC.CD.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】戴口罩是防控新型冠状病毒的重要手段,口罩生产的主要原料聚丙烯由丙烯聚合而来。丙烷脱氢是丙烯工业生产的重要途径,反应的热化学方程式为C3H8(g)![]() C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:
(1)从工业生产的角度来看制备丙烯所用的丙烷可以从下面工业气体中获得的是___________。
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图示。

①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是___________、___________。
②丙烷脱氢制丙烯反应在___________(选“高温”或低温”)时更加容易自发进行。
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是___________。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。

已知:CO和C3H6、C3H8的燃烧热△H分别为-283.0kJmol-1、-2049.0kJmol-1、-2217.8kJmol-1。
①298K时,该工艺总反应的热化学方程式为___________________________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
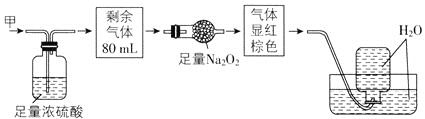
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是热量高、无污染的燃料,天然气储量丰富是理想的制氢原料,研究甲烷制氢具有重要的理论和现实意义。
(1)甲烷水蒸气重整制氢:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H1=+216kJmol-1,温度1200k,压强0.2Mpa,水碳起始物质的量之比3:1,达到平衡时氢气的物质的量分数为0.3,甲烷转化率为____,Kp=____(Mpa)2 。理论上近似水碳比为____,氢气的物质的量分数将达到最大。
CO(g)+3H2(g)△H1=+216kJmol-1,温度1200k,压强0.2Mpa,水碳起始物质的量之比3:1,达到平衡时氢气的物质的量分数为0.3,甲烷转化率为____,Kp=____(Mpa)2 。理论上近似水碳比为____,氢气的物质的量分数将达到最大。
(2)①将甲烷水蒸气重整和甲烷氧化重整两种方法结合,理论上按照空气、甲烷、水蒸气约15:7:1体积比进料(空气中氧气体积分数约为0.2),可以实现反应器中能量自给(不需要补充热量)。
甲烷氧化重整制氢:2CH4(g)+O2(g)=2CO(g)+4H2(g) △H2=____kJmol-1
②实际生产中,空气、甲烷、水蒸气按照约1:1:2体积比进料,增加水蒸气的作用是____,还能发生____(用化学方程式表示)反应,从而获得更多的氢气。
(3)甲烷水蒸气重整过程中,温度1000K,原料气以57.6Kgh-1通入容积为1L镍基催化反应器中,2-5s甲烷质量分数由7.32%变为5.32%,用甲烷表示2-5s的反应速率为____molmin-1 ,随着反应的进行反应速率会急速下降,可能的原因是甲烷等高温不稳定,造成____。有人提出将甲烷水蒸气重整和甲烷氧化重整两种方法结合则能解决这个问题,原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物),1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。
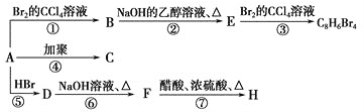
(1)A的化学式:________,A的结构简式________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C,D,E,H物质的结构简式:
C_________,D_________,E_______,H________。
(4)写出DF反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是白色菱形结晶体,毒性较低,对环境污染污染程度低,可作新型水处理剂和金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的 MoS2)制备钼酸钠的两种途径如图所示。

(1)途径Ⅰ焙烧过程中,为了提高焙烧效率,除增大空气量外还可以采用的措施有___; 在该过程的主要反应中,氧化剂与还原剂物质的量之比为________。
(2)途径Ⅱ氧化时还有 Na2SO4 生成,则反应的离子方程式为 ____________。
(3)已知途径Ⅰ的钼酸钠溶液中 c(MoO42-)=0.40 molL-1,c(CO32-)=0.10 molL-1。由钼酸钠溶液制备钼酸钠晶体时,需加入 Ba(OH)2 固体以除去 CO32-。在不损失 MoO42-的情况下,CO32-的最大去除率是 ____________ [已知 Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)途径Ⅱ中 Na2MoO4 溶液通过结晶的方法可得到 Na2MoO4 晶体。母液可以循环利用,但循环一定次数后必须对母液进行处理,试解释原因 _________。
(5)途径Ⅱ比途径Ⅰ的优点有 ________________(答出两条)。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图。
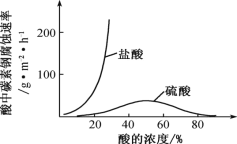

①当硫酸的浓度大于 90%时,碳素钢腐蚀速率几乎为零,原因是________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为 300 mgL-1,则缓蚀效果最好时钼酸钠(M=206 gmol-1)的物质的量浓度为 ________(计算结果保留 3 位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和甲烷等原料在工业生产中发挥着重要的作用。
Ⅰ.我国科学家以MoS2 为催化剂,通过调节催化剂/电解质的表界面相互作用,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图所示。
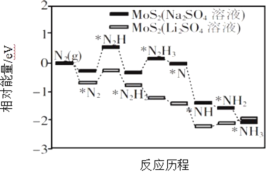
(1)将Na2SO4 溶液换成Li2SO4 溶液后,反应速率明显加快的主要原因是加快了下列____________转化的反应速率(填标号)。
A.N2→*N2 B.*N2→*N2H C.*N2H3→*N D.*NH→*NH2
Ⅱ. 甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(2)已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH1=akJ·mol—1,
2CO(g)+O2(g)= 2CO2(g) ΔH2=b kJ·mol—1,
2H2(g) +O2(g)=2 H2O (l) ΔH3=c kJ·mol—1
CO(g)+ H2O(g)= CO2(g)+ H2 (g) ΔH4=d kJ·mol—1
则甲烷水蒸气重整反应的ΔH=____________kJ·mol—1(用字母a、b、c、d表示)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2物质的量分数与水碳比、平衡温度的关系如图所示:
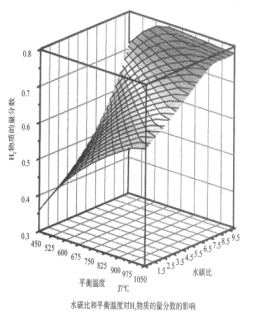
①结合如图回答:当平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系是________,其原因是_____________。
②若密闭容器中仅发生CH4(g)+H2O(g)![]() CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
CO(g)+3H2(g),平衡温度为750℃,水碳比为1.0时,H2的物质的量分数0.5,甲烷的转化率为___________,其压强平衡常数Kp为________;用气体分压表示反应速率方程为v=k p(CH4)·p—1(H2),则此时反应速率v=_________。(已知:气体分压=气体的物质的量分数×总压,速率方程中k 为速率常数)。
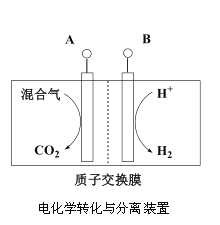
Ⅲ.利用天然气合成氨,并生产尿素的流程如下:
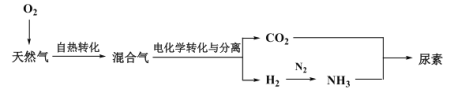
(3)“电化学转化与分离”装置如图,混合气中CO转化成CO2的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向碘水中滴加Na2SO3溶液时发生反应:Na2SO3+I2+H2O=2HI+Na2SO4,下列说法不正确的是
A.Na2 SO3为还原剂B.I2发生氧化反应
C.还原性:Na2SO3 > HID.每生成1molNa2SO4,理论上转移的电子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com