
| A. | 各物质的量浓度之比为c(A):c(B):c(C)=2:3:3 | |
| B. | 正逆反应速率相等且等于零 | |
| C. | 平衡混合物中各物质的量浓度相等 | |
| D. | 单位时间内,若消耗了amolA物质,则同时也消耗了1.5amolC物质 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、当体系达平衡状态时,各物质的量浓度之比为c(A):c(B):c(C)可能是2:3:3,也可能不是,与各物质的初始浓度及转化率有关,故A错误;
B、化学平衡是动态平衡,当反应达到平衡状态时,正逆反应速率相等,但不为0,故B错误;
C、平衡混合物中各物质的量浓度相等,并不是不变,故C错误;
D、单位时间内,若消耗了amolA物质,等效于生成了1.5amolC物质,则同时也消耗了1.5amolC物质,正逆反应速率相等,达平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:解答题
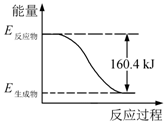 2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室.火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全燃烧生成氮气和1mol气态水过程中的能量变化图.
2016年9月我国成功利用大功率运载火箭发射“天宫二号”空间实验室.火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),如图是一定量肼完全燃烧生成氮气和1mol气态水过程中的能量变化图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO3与NaOH等物质的量反应:NH4++HSO3-+2OH-═NH3•H2O+SO32- | |
| B. | 铜与浓硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 1.0 mol•L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO42- | |
| D. | 过量SO2通入次氯酸钠溶液:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 反应类型加聚反应
反应类型加聚反应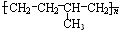 单体结构简式为CH2=CH2和CH3-CH=CH2.
单体结构简式为CH2=CH2和CH3-CH=CH2.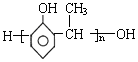 单体结构简式为
单体结构简式为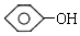 和CH3CHO.
和CH3CHO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔、沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CH3CH2Br>H2O>甲苯 | |
| C. | 等质量的物质燃烧耗O2量:乙烯>乙炔>甲烷 | |
| D. | 等物质的量物质燃烧耗O2量:环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
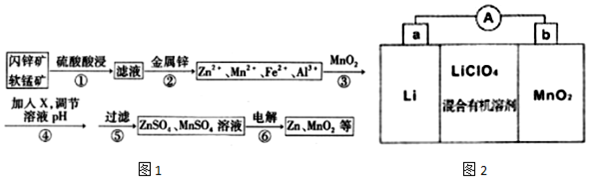
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1 Ca(ClO)2溶液中K+、Na+、I-、Cl-可以大量共存 | |
| B. | 氢氧化铁溶于氢碘酸中的离子方程式为:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 等体积和等物质的量浓度的CH3COONH4和NH3•H2O混合液中c(CH3COOH)+c(CH3COO-)═c(NH4+)+c(NH3•H2O) | |
| D. | 常温下,浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液显酸性,则:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
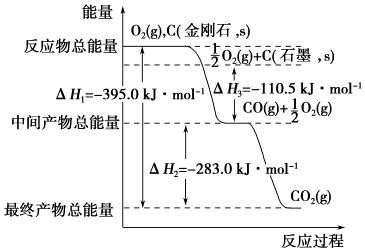
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “真金不怕火炼”说明有些金属(例如金)即使在高温下也不与氧气发生反应 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 含重金属离子的电镀废液不能随意排放 | |
| D. | 铜的金属活泼性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com