
| A、碳酸溶于水的电离方程式:H2CO3?CO32-+2H+ |
| B、标准状况下将112mL Cl2通入10 mL 1 mol?L-1 FeBr2溶液的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
C、用单线桥表示浓盐酸和KClO3反应的电子转移的数目与方向: |
D、过氧化钠的电子式为: |
 ,故C错误;
,故C错误; ,故D正确;
,故D正确;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 16、下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )
16、下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )| A、已知单质硼的结构单元是由20个正三角形构成的正二十面体,则这个结构单元中含有30个B-B键、12个硼原子 |
| B、SF6的分子空间构型为正八面体 |
| C、1 molHCN分子中有2 molσ键和2molπ键 |
| D、32gS8分子中含有0.125 molσ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大浓度 | B、增大压强 |
| C、升高温度 | D、使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S2-+2H2O?H2S+2OH- |
| B、Fe3++3H2O?Fe(OH)3+3H+ |
| C、CO32-+H2O?HCO3-+OH- |
| D、HS-+H2O?H2S↑+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
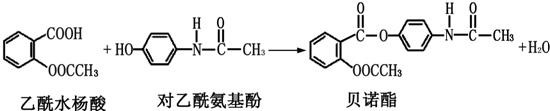
| A、上述反应类型为取代反应 |
| B、按碳的骨架分类,上述三种有机物均属于芳香烃 |
| C、1mol乙酰水杨酸最多能与含2mol NaOH的水溶液发生反应 |
| D、贝诺酯分子中有三种不同类型的含氧官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com