
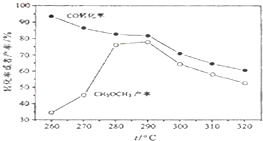
 (除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:
(除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:1.2V×
| ||
|
1.2V×
| ||
|


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O研读图,下列判断不正确的是( )
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O研读图,下列判断不正确的是( )| A、K 闭合时,d电极反应式PbSO4+2H2O-2e-=PbO2+4H++SO42- |
| B、当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol |
| C、K闭合时,II中SO42-向c电极迁移 |
| D、K闭合一段时间后,II可单独作为原电池,d电极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| A、被还原的硝酸为0.08mol |
| B、反应后溶液中仍有硝酸剩余 |
| C、反应后溶液的pH=1 |
| D、CuS未全部参加反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
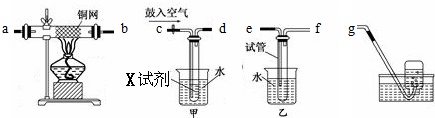
查看答案和解析>>
科目:高中化学 来源: 题型:
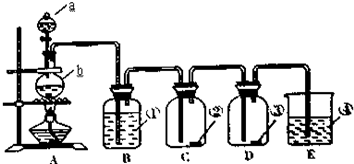
查看答案和解析>>
科目:高中化学 来源: 题型:
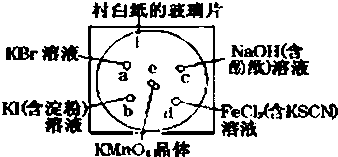
查看答案和解析>>
科目:高中化学 来源: 题型:
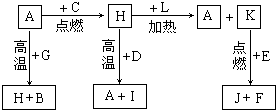 A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体.以上物质相互间的转化关系如图所示:
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体.以上物质相互间的转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| B、镁原子由1s22s22p63s2→1s22s22p63p2时,原子吸收能量,由基态转化成激发态 |
| C、最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大 |
| D、价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com