

分析 (1)原电池中活泼金属做负极;负极上活泼金属失电子发生氧化反应;正极上溶液中的阳离子得电子;原电池中电子从负极流向正极;原电池中阴离子移向原电池的负极;
(2)由方程式可知,Cu被氧化,为原电池的负极,则正极可为碳棒,电解质溶液为氯化铁溶液,正极发生还原反应,负极发生氧化反应,以此解答该题.
解答 解:(1)①在Cu-Zn原电池中,活泼金属Zn做负极;负极上Zn失电子发生氧化反应生成锌离子,其电极反应为:Zn-2e-=Zn2+;正极上溶液中的铜离子得电子生成Cu,其电极反应式为:2H++2e-=2H2↑;
故答案为:氧化;Zn-2e-=Zn2+;正; 2H++2e-=2H2↑;
②原电池中电子从负极流向正极,所以外电路中,电子流向正极;原电池中阴离子移向原电池的负极,则内电路溶液中,SO42-移向负极;
故答案为:正;负;
(2)由方程式Cu+2FeCl3=CuCl2+2FeCl2可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
Cu被氧化,为原电池的负极,则正极可为碳棒,电解质溶液为氯化铁,
则原电池装置图可设计为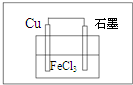 ,
,
故答案为: ;Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
;Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
点评 本题考查了原电池原理及原电池的设计,原电池的设计关键是负极材料和电解质溶液的成分,一般来说,还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液,题目难度中等.


科目:高中化学 来源: 题型:填空题
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)
(某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞a,通入一段时间氮气,关闭活塞a | 无明显实验现象 |
| Ⅱ | 打开活塞b,滴加氯水,关闭活塞b | A中溶液变为红棕色. |
| Ⅲ | 打开活塞a,吹入氮气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| Ⅳ | 停止吹入氮气,关闭活塞a;打开活塞c,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
| Ⅴ | 打开活塞b,滴加氯水 | A中溶液变为红棕色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
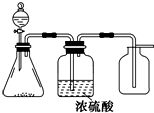 如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碱石灰和浓氨水 | B. | 锌和稀硫酸 | C. | 碳酸钙和稀盐酸 | D. | 铜和稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和
 与
与  ; ⑧35Cl和37Cl
; ⑧35Cl和37Cl
| 各组物质互为 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
| 填写序号 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 从反应开始到建立平衡所需时间:tA<tB | |
| B. | 平衡时I2的浓度:c(I2)A=c(I2)B | |
| C. | 平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器 | |
| D. | 平衡时HI的分解率:αA=αB |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.
效成分,其过程称为萃取;从碘水中提取碘采用萃取(或萃取分液)操作.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com