
【题目】Ⅰ.分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计,请回答下列问题:
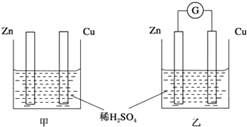
(1)以下叙述中,正确的是____。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为___________;乙为_________。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:___________________________________。
Ⅱ.氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池。
(1)如果是碱性燃料电池则负极反应方程式是:____________________。
(2)如果是酸性燃料电池则正极反应方程式是:___________________。
【答案】 C、D 化学能转化为热能 化学能转化为电能 Cu2++2e﹣![]() Cu H2-2e﹣+2OH﹣
Cu H2-2e﹣+2OH﹣![]() 2H2O O2+4e﹣+4H+
2H2O O2+4e﹣+4H+![]() 4H2O
4H2O
【解析】Ⅰ.(1)A.甲不能组成原电池,锌与稀硫酸之间发生置换反应,A错误;B.甲不能组成原电池,锌表面产生氢气,乙构成原电池,锌是负极,铜是正极,氢离子在铜电极表面产生气体,B错误;C.两烧杯中均消耗氢离子放出氢气,氢离子浓度均减小,所以溶液pH均增大,C正确;D.通过原电池的反应速率快,则产生气泡的速度甲中比乙中慢,D正确;E.乙的外电路中电流方向Zn←Cu,E错误,答案选CD;(2)甲不能构成原电池,乙是原电池,则变化过程中能量转化的形式主要是:甲为化学能转化为热能,乙为化学能转化为电能。(3)在乙实验中,如果把硫酸换成硫酸铜溶液,则铜离子在正极放电,所以铜电极的电极反应方程式为Cu2++2e-=Cu。
Ⅱ.(1)如果是碱性燃料电池,负极是氢气放电,则负极反应方程式为H2-2e-+2OH-=2H2O;(2)如果是酸性燃料电池,氧气在正极放电,则正极反应方程式是O2+4e-+4H+=4H2O。


 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色. 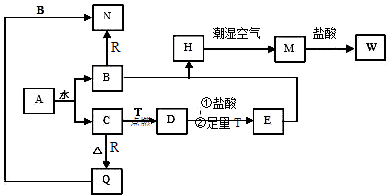
(1)写出下列物质的化学式:A , D , E , R , T .
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: .
(3)按要求写方程式:B和R反应生成N的离子方程式:;M→W的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4 , 与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程.回答下列问题: 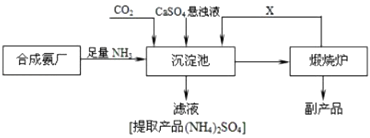
(1)工业合成氨所需氮气来自空气,常用物理方法获;该方法是;
(2)工业合成氨反应的化学方程式是
(3)沉淀池中发生反应的主要方程式是
(4)上述生产流程中,有关NH3的作用及说明正确的是 A.提供制各产品所需的氮元素
B.增大CO32﹣的浓度促进反应发生
C.作反应的催化剂
(5)可以循环使用的X是 . 从绿色化学和资源综合利用的角度说明上述流程的主要优点是 .
(6)写出硫酸钙的其它一种用途 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A. 单位时间内生成n molA2同时生成n molAB
B. 容器内的总物质的量不随时间变化
C. 单位时间内生成2n molAB的同时生成n molB2
D. 单位时间内生成n molA2的同时生成n molB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日照市是山东半岛蓝色经济区的重要组成部分,对海洋资源的开发受到高度重视,下列说法正确的是
A.Mg和U都属于海水中的微量元素
B.可以利用太阳能将海水蒸馏淡化生产饮用水
C.从海水中提取溴的过程不涉及氧化还原反应
D.海底多金属结核矿含有Fe、Mn、Co、B等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2。Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的2/3倍,试回答:
(1)X元素的名称:_______,Y元素在元素周期表中的位置_____________,Z元素的原子结构示意图____________。
(2)Y2X对应水化物的电子式____________,其中存在的化学键有____________。
(3)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因___________________。
(4)用电子式表示Y2X的形成过程:________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3 g纯净金属钠在干燥空气中被氧化后得到3.5 g固体,由此可判断产物是( )
A. 只有Na2O B. 只有Na2O2
C. Na2O和Na2O2的混合物 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌片和银片用导线相连浸入稀硫酸中组成原电池.该电池中负极发生反应(填“氧化”或“还原”);溶液中的H+移向(填“正极”或“负极”).若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质变质量为47g,试计算产生氢气的体积(标准状况) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com