
| A、至少存在5种离子 |
| B、Cl-一定存在,且c(Cl-)≥0.1mol/L |
| C、SO42-、NH4+一定存在,Cl-可能不存在 |
| D、CO32-、Al3+一定不存在,K+可能存在 |
| 0.01mol |
| 0.1L |


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
| A、CH3CH2CH2CH2CH2CH3 |
B、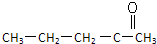 |
| C、CH2═CH-CH═CH2 |
| D、(CH3)3C-C≡C-CH=CHCH3CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| 加热 |
| 化合物 | 密度/g?cm-3 | 沸点/℃ | 溶解度/g |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | ∞ |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、试管塞越来越紧,是因为反应消耗了大量O2 |
| B、打开试管塞前Cu元素的化合价为+1价 |
| C、溶液迅速变为蓝色溶液,是因为反应生成了[Cu(H2O)4]2+ |
| D、上述反应原理可用于测定O2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.| 放电 |
| 充电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 硫酸铜/g | 14.8 | 20.5 | 28.5 | 39.6 | 53.6 | 73.0 |
| 硝酸铜/g | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com