
【题目】常温下,下列有关离子浓度及pH大小的比较,正确的是( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
【答案】D
【解析】①(NH4)2Fe(SO4)2溶液中Fe2+的水解对于铵根离子的水解起到抑制作用, ②(NH4)2CO3 中碳酸根离子水解对于铵根离子的水解起到促进作用,③(NH4)2SO4溶液中硫酸根离子对铵根离子的水解无影响,所以溶液中铵根离子的水解程度的大小顺序为:②>③>①。则要达到相同的铵根离子浓度,水解程度大的溶液,物质的浓度应该越大,即溶液浓度由大到小的顺序是:②>③>①。选项A错误。由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,由于醋酸的浓度远大于氢氧化钠的浓度,所以中和以后得到醋酸钠(较少)和醋酸(较多)的混合溶液,溶液显酸性,即c(H+)>c(OH-),根据电荷守恒得到:c(CH3COO-)>c(Na+)。又因为钠离子是醋酸钠完全电离生成的,氢离子使醋酸微弱电离得到的,所以有c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。选项B错误。pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合,两溶液的氢氧根离子和氢离子的浓度刚好相等,等体积混合,恰好中和,溶液显中性。选项C错误。pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,其![]() ,所以
,所以![]() ,
, ![]() ,选项D正确。
,选项D正确。
【题型】单选题
【结束】
14
【题目】室温下,下列溶液中粒子浓度关系正确的是( )
A. Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4)
B. 20mL0.1molL-1CH3COONa溶液与10mL0.1molL-1HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D. pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
【答案】B
【解析】碳酸钠溶液的质子守恒为:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),选项A错误。20mL0.1molL-1CH3COONa溶液与10mL0.1molL-1HCl溶液混合后得到c(CH3COONa)= c(CH3COOH)= c(NaCl)的混合溶液。溶液显酸性,说明CH3COOH的电离大于CH3COONa的水解,得到:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),选项B正确。CH3COONa的物料守恒为c(Na+)=c(CH3COO-)+c(CH3COOH),CaCl2溶液中一定有2c(Ca2+)= 2c(Cl-),两个等式相加得到:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),选项C错误。溶液有电荷守恒:c(Cl-)+c(OH-)=c(NH4+)+ c(H+),即c(Cl-)=c(NH4+)+ c(H+)- c(OH-),将其带入题目给的式子得到:c(NH4+)+ c(H+)- c(OH-)+c(H+)>c(NH4+)+c(OH-),化简得到c(H+)>c(OH-),即如果题目的结论是对的,则溶液一定显酸性。题目是pH=2的盐酸与pH=12的氨水等体积混合,因为氨水的浓度远大于盐酸,最后一定是氨水完全过量,溶液显碱性,选项D错误。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
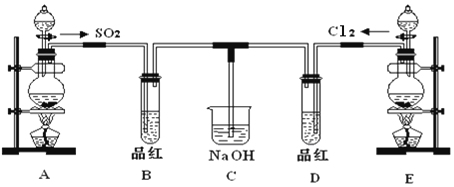
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是__________________。
(2)实验室用装置E制备Cl2,其反应的化学方程式为__________________________;若有8mol的HCl参加反应,则转移的电子总数为________。
(3)该装置中氢氧化钠溶液的作用是___________________。
(4)通气后B、D两个试管中的现象______________。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________,D:________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生:3A(g)+B(g) ===2C(g) 的反应,若最初加入A和B都是4 mol,A的平均反应速率是0.12 mol·L-1·s-1,则10 s后容器中B的浓度为
A. 2.8 mol·L-1 B. 1.6 mol·L-1 C. 3.2 mol·L-1 D. 3.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.聚甲基丙烯酸甲酯(PMMA)俗称有机玻璃。其结构简式为: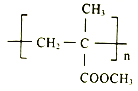 。以下是有机玻璃的一种合成路线:
。以下是有机玻璃的一种合成路线:
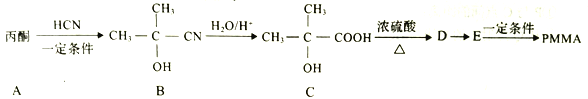
回答下列问题:
(1)A的结构简式为________,A生成B的反应类型是______反应。
(2)C中官能团的名称是________ ,D的名称是________(系统命名法)。
(3)由E生成PMMA的化学方程式为____________。
II.由合成PMMA得到的启示,可应用于由苯酚为主要原料制备![]()
(4)![]() 的同分异构体中符合下列条件的有_____种(不考虑立体异构):
的同分异构体中符合下列条件的有_____种(不考虑立体异构):
①属于![]() 的二取代物
的二取代物
②取代基处于对位且完全相同
③能够与NaHCO3溶液反应产生CO2
其中核磁共振氢谱有5个峰,峰面积之比为6:2:1:1的是_________(填结构简式)。
(5)参照I中有机玻璃的合成路线,设计并完善![]() 的合成路线:
的合成路线:
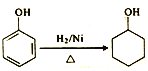 ____________
____________![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是细胞中3种化合物含量的扇形图,图2是活细胞中元素含量的柱形图,下列说法中不正确的是( )
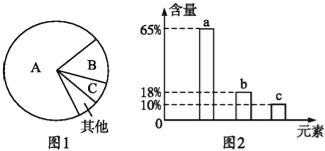
A. 图1中A、B、C分别是水、蛋白质、脂质;图2中a、b、c三种元素依次表示碳、氢、氧
B. 若图1表示正常细胞,则B化合物具有多样性,其必含图2中的a、b、c
C. 若图1表示正常细胞,则A中不含图2中的b
D. 图1可以表示人体细胞完全脱水后化合物含量的扇形图,而此时含量最多的元素为图2中的b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别加到HF溶液、CH3COOH溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,已知pKa=-lgKa,下列有关叙述错误的是
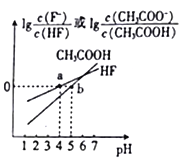
A. 常温下,Ka(CH3COOH)=10-5
B. a点时,c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mol/LNaF溶液的pH小于0.1mol/LCH3COONa溶液的pH
D. 向CH3COOH溶液中加入NaOH溶液后所得的混合溶液中, 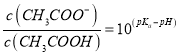
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学--有机化学基础】有机物G(![]() )是一种调香香精,可用作抗氧剂,工业上合成它的路线图之一如下:
)是一种调香香精,可用作抗氧剂,工业上合成它的路线图之一如下:

(1)A中官能团的名称是_____,B→C的反应类型为_________。
(2)G分子中一定共平面的碳原子有______个。
(3)反应F→G中消耗的F与CH3MgBr的物质的量之比为______,B在浓硫酸存在下加热可通过一步反应得到E物质,但合成不采用此方法,其原因是__________。
(4)C→D的化学方程式为_______________。
(5)E有多种同分异构体,其中满足下列条件的同分异构体有_____种,写出核磁共振氢谱有4个吸收蜂的物质的结构简式:_______。
①含有一个六元环 ②1mol同分异构体与足量银氨溶液发生银镜反应生成4 mol Ag
(6)已知A转化为B的原理与F转化为G的相似,请设计以A为起始原料(其他试剂任选)制备![]() 的合成路线______________。
的合成路线______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AB3易溶于有机溶剂,不溶于水,则下列说法正确的是( )
A. AB3是非极性分子 B. A原子p能级中无空轨道
C. A原子为sp3杂化 D. AB3为三角锥形结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com