
���ĸ������ǩ���Լ�ƿ�У��ֱ�ʢ�����ᡢBaCl2��Һ��Na2CO3��Һ��AgNO3��Һ��Ϊ�˼����ƿ�е��Լ��������Ƿֱ���ΪA��B��C��D��������ϣ���ʵ������Ϊ��A+B������ɫ���壻B��C������ɫ������A��D������ɫ������A��C�����Ա仯��
��1���ɴ��Ƴ����Լ�ƿ��ʢ�ŵ��Լ�Ϊ���ѧʽ����
A__________��B__________��C__________��D__________��
��2��A��B��Ӧ�����ӷ���ʽΪ______________________________��
��3��A��D��Ӧ�����ӷ���ʽΪ______________________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и����뷴Ӧ�ȵĴ�С�ص��� �� ��
A.��Ӧ����������״̬ B.��Ӧ�����Ķ���
C.��Ӧ������� D.��Ӧ�Ŀ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������ȷ����
A��������ԭ��Ӧ�ı�����Ԫ�ػ��ϼ۷����˸ı�
B�������ϼ�����Ԫ�صķ�Ӧ�ﱻ����
C���õ����ӵ����ʱ�����
D��������ԭ��Ӧ�У��������ͻ�ԭ��һ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ (HNO2) �ȿ����������ֿ�����ԭ�������ڷ�Ӧ����������ʱ���������ɵIJ����ǣ� ��
A�� N2 B��N2O3 C��HNO3 D��NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ȥNaCl�к��е�Ca2����Mg2����SO42-�����ӣ�ͨ���������������Լ�����Na2CO3 ��BaCl2 ��NaOH ��HCl�������Լ������IJ���˳����( )
A���٢ڢۢ� B���ۢ٢ڢ� C���ܢڢ٢� D���ۢڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪299Kʱ���ϳɰ���Ӧ3H2(g)��N2(g) 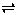 2NH3(g) ��H=-92.0kJ/mol�������¶��µ�1molN2��3molH2����һ���ܱ������У��ڴ������ڵ�ʱ����з�Ӧ����÷�Ӧ�ų�������Ϊ������������ʧ��
2NH3(g) ��H=-92.0kJ/mol�������¶��µ�1molN2��3molH2����һ���ܱ������У��ڴ������ڵ�ʱ����з�Ӧ����÷�Ӧ�ų�������Ϊ������������ʧ��
A��һ������92.0kJ B��һ������92.0k
C��һ��С��92.0kJ D������ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
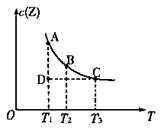
���ݻ�������ܱ��������з�Ӧ��X(g)+Y(g) 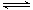 z(g)����Z(g)�����ʵ���Ũ��c(Z)���¶�T�Ĺ�ϵ����ͼ��ʾ(�����ϵ�����һ�㶼��ʾƽ��״̬)��������˵������ȷ����
z(g)����Z(g)�����ʵ���Ũ��c(Z)���¶�T�Ĺ�ϵ����ͼ��ʾ(�����ϵ�����һ�㶼��ʾƽ��״̬)��������˵������ȷ����
A��A����B����ȣ�B���c(X)��
B. A����C��Ļ�ѧ��Ӧ���ʣ�A<C
C.�ڷ�Ӧ���е�D��ʱ��v��>v��
D���÷�Ӧ������Ӧ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ЧӦ���Ǹ籾��������仯����о��Ļ�������֮һ��CO2��Ŀǰ�����к�����ߵ�һ���������塣��ˣ����ƺ�����CO2�ǽ��������ЧӦ������Ч;����
��1�����д�ʩ�У������ڽ��ʹ�����CO2Ũ�ȵ��� ��������ĸ��ţ�
a�����ý��ܼ��������ٻ�ʯȼ�ϵ�����
b�������������������У�������̼����
c������̫���ܡ����ܵ�������Դ�����ʯȼ��
��2����һ��;���ǽ�CO2ת�����л���ʵ��̼ѭ�����磺
2CO2(g)��2H2O(l) == C2H4(g)��3O2(g) ��H��+1411.0 kJ/mol
2CO2(g)��3H2O(l) == C2H5OH(1)��3O2(g) ��H��+1366.8 kJ/mol
������ϩˮ�����Ҵ����Ȼ�ѧ����ʽ�ǣ� ��
��3����һ�������£�6H2(g) +2CO2(g)  CH3CH2OH(g)+3H2O(g)��
CH3CH2OH(g)+3H2O(g)��
|
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
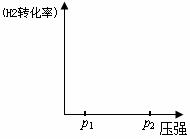
�����ϱ������ݷ�����
�� �¶�һ��ʱ�������̼�ȣ�CO2��ת���� ���������С�����䡱����
�� �÷�Ӧ������ӦΪ ��������š����ȷ�Ӧ��
�� ��ͼһ������ϵ����ͼ��˵��ѹǿ��p1����p2ʱ������ƽ���ƶ�����H2ת���ʺ��Ҵ��ٷֺ����ı仯��
--
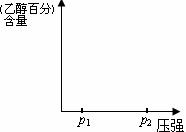
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2A��B  3C��4D��Ӧ�У���ʾ�÷�Ӧ����������
3C��4D��Ӧ�У���ʾ�÷�Ӧ����������
A��v��A����0.5 mol���̣�1����1 B��v��B����0.3 mol���̣�1����1
C��v��C����0.8 mol���̣�1����1 D��v��D����1 mol���̣�1����1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com