
| A. |  的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 全降解塑料(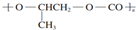 )可由单体环氧丙烷( )可由单体环氧丙烷(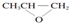 )和CO2加聚制得 )和CO2加聚制得 | |
| C. | 1mol乙酰水杨酸(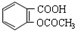 )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
分析 A..选取含碳原子最多的为主碳链,离取代基近的一端编号确定取代基位置,写出名称;
B.缩聚反应有小分子生成;
C.乙酰水杨酸含有羧基、酯基;
D.油脂不是高分子化合物.
解答 解:A.选取含碳原子最多的6个碳原子为主碳链,离取代基近的一端编号确定取代基位置,名称为2,5-二甲基-3-乙基己烷,故A错误;
B.缩聚反应有小分子生成,全降解塑料(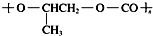 )可由单体环氧丙烷(
)可由单体环氧丙烷(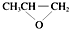 )和CO2加聚制得,故B正确;
)和CO2加聚制得,故B正确;
C.乙酰水杨酸含有羧基、酯基,且酯基可水解生成酚羟基,乙酰水杨酸含有羧基、酯基,且酯基可水解生成酚羟基,则1mol乙酰水杨酸最多能与3molNaOH发生反应,故C错误.
D.高分子化合物的相对分子质量一般在10000以上,油脂不是高分子化合物,故D错误;
故选B.
点评 本题考查有机物的命名判断,题目难度中等,该题侧重对学生基础知识的检验和训练,关键是明确有机物的命名原则,然后结合有机物的结构简式灵活运用即可,有利于培养学生的规范答题能力及灵活应用所学知识的能力.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:解答题
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
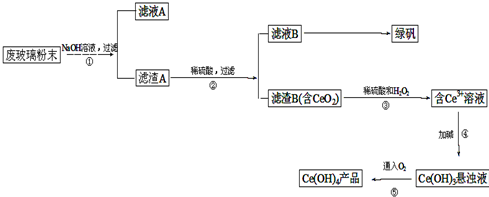
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的气态氢化物比N的气态氢化物稳定 | |
| B. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| C. | M与X形成的化合物对应的水化物一定是强酸 | |
| D. | Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
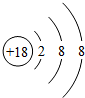 ,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.
,由2个原子组成的分子是HCl、由2原子组成具有10电子的阴离子OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液不能用带磨口玻璃塞的玻璃瓶盛放 | |
| B. | CO2与水反应生成碳酸,是酸性氧化物;SiO2不能与水反应生成硅酸,不是酸性氧化物 | |
| C. | 除去二氧化硅中少量的碳酸钙杂质应选用水 | |
| D. | 粗硅制备时,发生的反应为C+SiO2═Si+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
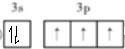 ,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).
,上述反应涉及的第二周期元素中第一电离能由大到小的顺序为F>O>C(用元素符号表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com