
为除去粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)上述实验中第⑤步操作需要烧杯、____________、___________等玻璃仪器。
(2)判断BaCl2已过量的方法是 。
(3)第④步中所有相关的化学方程式是 、 。
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是 。
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源:2015-2016学年福建省四地六校高二上学期10月联考化学试卷(解析版) 题型:选择题
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按右式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2 由此可知,该电池充电时在阴极上发生反应的是
Cd(OH)2+2Ni(OH)2 由此可知,该电池充电时在阴极上发生反应的是
A.Ni(OH)2 B.Cd(OH)2 C.Cd D.NiOOH
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期10月月考化学试卷(解析版) 题型:选择题
工业上常利用CO与SO2反应生成固态S单质和CO2,从而消除这两种气体对大气的污染:2CO(g)+SO2(g) 2CO2(g)+S(s)△H=﹣a kJ/mol(a>0),下列叙述正确的是
2CO2(g)+S(s)△H=﹣a kJ/mol(a>0),下列叙述正确的是
A.该反应的平衡常数表达式为K=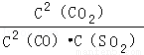
B.若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ
C.增大压强或升高温度都可以加快化学反应速率并提高SO2的转化率
D.若单位时间内生成2 molCO2的同时,消耗1mol SO2,则说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:填空题
Ⅰ.聚四氟乙烯在耐热性和化学稳定性上都超过了其他塑料,号称“塑料之王”,可用于制造飞机、导弹的无油轴承,密封填料,人造血管,滑雪板,不粘锅等。其合成路线如下图所示:

写出下列化学反应方程式。
B→C:_______ _________________
C→D:_____________ _
Ⅱ.实验室制取乙烯气体时,常因温度过高混合液迅速变黑,并产生具有刺激性气味的气体SO2。某同学设计了如图所示的实验装置以确证反应制得的混合气体中含有乙烯和SO2。

可供选择的试剂:①酸性高锰酸钾溶液、②稀硝酸、③浓硫酸、④品红溶液、⑤石蕊试液、⑥NaOH溶液。
(1)各装置中所盛放的试剂分别是(填写序号):A_________,B_________,C_________,D_________。
(2)装置B的作用是__________________,装置C的作用是___________________。
(3)能说明混合气体中含SO2的实验现象是_________ ______,确证混合气体中有乙烯的实验现象是____ __。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二上学期10月月考化学试卷(解析版) 题型:填空题
如右图所示装置为在直流电流作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
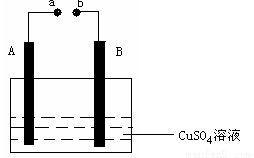
(1)a为电源的 极。B叫电解槽的 极,电路中流过的电子的数目为
(2)写出电极反应方程式:A ,B 。
(3)如果想使反应溶液恢复到原来状态,应该加入 g
查看答案和解析>>
科目:高中化学 来源:2016届江苏省无锡市高三上学期10月月考化学试卷(解析版) 题型:填空题
(15分)实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:
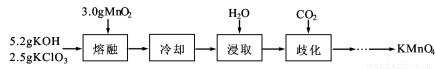
(1)熔融时需用铁坩埚和铁制搅拌棒而不能用玻璃仪器,其原因是 。
(2)熔融时,MnO2转化为K2MnO4,KClO3转化为KCl,其反应的化学方程式为 。
(3)几种物质的溶解度曲线如图所示。

①歧化时,通入CO2至pH为10~11,K2MnO4绿色溶液转化为KMnO4和MnO2。其反应的离子方程式为 。
②歧化时不能通入过量CO2的原因是 。
③通入CO2后,用玻璃棒蘸取溶液点于滤纸上,观察到 ,证明歧化反应已发生。
④歧化后得到KMnO4晶体的操作依次为过滤、 、 及干燥。
(4)在此实验流程中可循环使用的物质的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市高三上学期返校联考化学试卷(解析版) 题型:选择题
一定条件下,反应:C(s)+CO2(g) 2CO(g),ΔH>0在2L恒容密闭容器中进行,反应进行20s时,CO的物质的量增加了0.40 mol,则下列说法正确的是
2CO(g),ΔH>0在2L恒容密闭容器中进行,反应进行20s时,CO的物质的量增加了0.40 mol,则下列说法正确的是
A.反应20s,C的平均反应速率v (C) =0. 005 mol·L-1·s-1
B.反应平衡时,v (CO2): v (CO) =1:2
C.升高温度时,正反应速率增大,逆反应速率减小
D.充入N2使体系压强增大,能提高反应速率
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省临沂市高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列判断正确的是
A.1 L H2O中溶解了0.5 mol NaCl,则该溶液的物质的量浓度为0.5 mol·L-1
B.从1 L 1 mol·L-1蔗糖(C12H22O11)溶液中取出100 mL溶液,其物质的量的浓度仍为1 mol·L-1
C.0.5 mol·L-1的NaOH溶液中,含有0.5 mol Na+
D.1 L H2SO4溶液中含有98 g H2SO4,则该溶液的物质的量浓度为98 g·L-1
查看答案和解析>>
科目:高中化学 来源:2016届江西省红色七校高三上学期第一次联考化学试卷(解析版) 题型:填空题
(10分)纯过氧化氢是淡蓝色的黏稠液体,可任意比例与水混合,是一种强氧化剂,水溶液俗称双氧水,为无色透明液体。其水溶液适用于医用伤口消毒及环境消毒和食品消毒。
(1)请写出H2O2的电子式 。
(2)往硫酸中加入一定浓度的双氧水可将溶解铜,写出该反应的离子方程式_________________。
(3)Fe3+催化H2O2分解的机理可分两步反应进行,第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
请完成第二步反应的离子方程式:
 Fe2++
Fe2++  H2O2 +
H2O2 +  _________ ==
_________ ==  _________+
_________+  _________
_________
(4)下图是一种用电解原理来制备过氧化氢并用产生的H2O2处理废氨水的装置
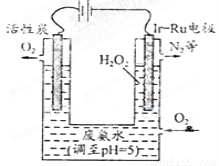
①为了不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)____ c(NO3-)(填“>”、“<”或“=”)。
②Ir-Ru惰性电极有吸附O2作用,该电极上的反应为 。
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com