

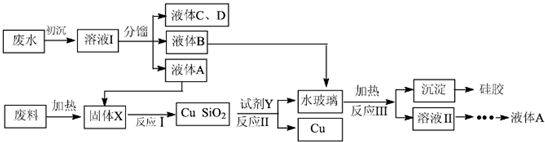
分析 (1)甘蔗渣用稀硫酸浸泡,水解得到葡萄糖,再加入稀硝酸进行氧化得到草酸,在A三颈烧瓶中发生反应;B为球形冷凝管,硝酸易挥发,冷凝回流硝酸;
(2)根据草酸的回收率最高时判断最佳反应温度;由于温度不超过100℃,所以采用水浴加热,便于控制温度,且能使装置受热均匀;
(3)①根据草酸溶液的酸碱性及量取溶液的精确度选用相应的仪器;
②滴定终点读取滴定管刻度时,仰视标准液液面,会使消耗高锰酸钾溶液的体积读数偏大;
③由于酸性高锰酸钾溶液显紫红色,草酸反应完毕,滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红,反应到达终点;
④根据n=cV计算反应中消耗高锰酸钾的物质的量,根据方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O计算草酸的物质的量,再计算原样品中草酸的物质的量,进而计算草酸晶体的纯度.
解答 解:(1)甘蔗渣用稀硫酸浸泡,水解得到葡萄糖,再加入稀硝酸进行氧化得到草酸,在A三颈烧瓶中发生反应;B为球形冷凝管,硝酸易挥发,冷凝回流硝酸,
故答案为:三颈烧瓶;球形冷凝管;冷凝回流硝酸;
(2)根据图3可知,在温度为70℃时,草酸的收率最高,所以选择的最佳反应温度是70℃.由于温度不超过100℃,所以采用水浴加热,便于控制温度,且能使装置受热均匀;
故答案为:70℃;便于控制温度,使装置受热均匀;
(3)①草酸溶液显酸性,所以量取25.00mL草酸溶液的仪器是酸式滴定管,
故答案为:酸式滴定管;
②滴定终点读取滴定管刻度时,仰视标准液液面,会使消耗高锰酸钾溶液的体积读数偏大,导致计算所得草酸的量增大,使实验误差偏高,
故答案为:偏高;
③由于酸性高锰酸钾溶液显紫红色,所以滴定终点的判断依据是向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色;
故答案为:向锥形瓶中滴入最后一滴高锰酸钾标准液,锥形瓶中溶液变成浅红色且半分钟后不变色;
④反应中消耗高锰酸钾的物质的量是0.02L×0.1000mol/L=0.002000mol,根据方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,可知25mL溶液中草酸的物质的量是0.002000mol×$\frac{5}{2}$=0.005000mol,因此原样品中草酸的物质的量是0.005000mol×$\frac{250mL}{25mL}$=0.05000mol,则质量=0.05000mol×126g/mol=6.3g,所以草酸的纯度是$\frac{6.3g}{7.2g}$×100%=87.5%.
故答案为:87.5%.
点评 本题考查有机物制备实验方案设计,涉及化学仪器、对装置的分析评价、实验条件的选择控制、物质含量的沉淀、氧化还原反应滴定等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③④⑤ | C. | ①②④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别点燃,有黑烟生成的是苯 | |
| B. | 分别加入溴水振荡,静置后分层,上、下两层红棕色均消失的是己烯 | |
| C. | 分别加入溴水振荡,静置后分层,下层红棕色消失的是己烯 | |
| D. | 分别加入酸性高锰酸钾溶液,振荡,静置后水层紫色消失的是己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
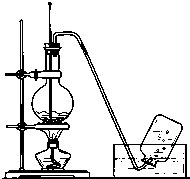 实验室常用如图所示装置制取乙烯,制取时:
实验室常用如图所示装置制取乙烯,制取时:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
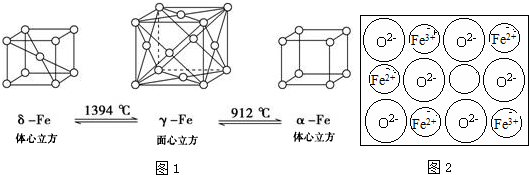
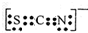 .Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.
.Fe3+与SCN-可以形成配位数1~6的配离子,若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜是一种紫红色金属 | |
| B. | 铜是热和电的良导体 | |
| C. | 铜是人类使用最早、应用最广泛的金属之一 | |
| D. | 铜在自然界中主要以单质的形式存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有非极性共价键的化合物分子一定是非极性分子 | |
| B. | 原子晶体中只存在非极性共价键 | |
| C. | 冰主要是水分子通过氢键作用而形成的分子晶体 | |
| D. | 若元素R的含氧酸的酸性大于元素Q的含氧酸的酸性,则非金属性R大于Q |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com