
在恒温恒压的密闭容器中,充入 4L X和 3L Y的混合气体,在一定条件下发生下列反应:
4X(g)+ 3Y(g)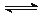 2Q(g)+ nR(g)达到平衡时测得 X的转化率为 25%,此时混和
2Q(g)+ nR(g)达到平衡时测得 X的转化率为 25%,此时混和
气体的体积为6.5L。则该反应方程式中的n值为: ( )
A.8 B.6 C.5 D.3
科目:高中化学 来源: 题型:
反应2Z(g) X(g)+ Y(g),△H>0。达到平衡时,下列说法正确的是( )
X(g)+ Y(g),△H>0。达到平衡时,下列说法正确的是( )
A.加入催化剂,X的产率增大 B.升高温度,Y的转化率增大
C.当容器活塞可活动时,充入稀有气体,平衡不移动 D.充入Z气体时,Z的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是
A.将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
B.1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个HSO4-
C.常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子
D.1 mol铁与足量稀盐酸反应转移的电子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.一定条件下,增大反应物的量会加快化学反应速率。
B.增大压强,肯定会加快化学反应速率。
C.活化分子间所发生的碰撞一定为有效碰撞。
D.能够发生有效碰撞的分子一定是活化分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电解槽的阴极
④冶炼铝时,把氧化铝加入液态冰晶石中成为熔融体后电解
⑤钢铁表面常易锈蚀生成Fe2O3·nH2O
A.①②③④⑤ B.①③④⑤ C.①③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)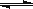 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ▲ ,△H ▲ 0(填“<”“ >”“ =”);
(2) 830℃时,向一个 5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1。,则6s时c(A)= ▲ mol·L-1,C的物质的量为 ▲ mol;反应经一段时间后达到平衡,此时A的转化率为 ▲ ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ▲ ;
(3)判断该反应是否达到平衡的依据为 ▲ (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成C和A的物质的量相等
(4)1200℃时反应C(g)+D(g)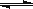 A(g)+B(g)的平衡常数的值为 ▲ 。
A(g)+B(g)的平衡常数的值为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况。下列反应中属于这种情况的是
A.过量的浓盐酸与MnO2反应 B.过量的Zn与18 mol/L的硫酸反应
C.过量的Fe与稀硝酸反应 D.过量的H2与N2在催化剂存在下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1) ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
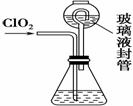

(2) 写出电解时发生反应的化学方程式:____________。
(3) 除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4) 测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O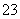 = 2I-+S4O
= 2I-+S4O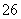 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
①装置中玻璃液封管的作用是_______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________。
③滴定终点的现象是________________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5) 用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO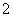 。2001年我国卫生部规定,饮用水的ClO
。2001年我国卫生部规定,饮用水的ClO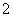 含量应不超过0.2 mg·L-1。若饮用水中ClO
含量应不超过0.2 mg·L-1。若饮用水中ClO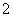 的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com