
| A. | SiO2 CaO NaCl CBr4 CF4 | |
| B. | SiO2 NaCl CaO CF4 CBr4 | |
| C. | CaO NaCl SiO2 CBr4 CF4 | |
| D. | CF4CBr4NaCl CaO SiO2 |
分析 不同晶体的熔点:一般为原子晶体>离子晶体>金属晶体>分子晶体;相同晶体从影响晶体熔沸点高低的因素分析.
解答 解:SiO2为原子晶体,CaO和NaCl 为离子晶体,离子键与离子半径和离子所带电荷有关,离子半径越大和离子所带电荷越小,离子键越弱,熔点越小,半径Ca2+>Na+,Cl->O2-,所以NaCl的离子键最弱,熔点最低,而不同晶体的熔点:一般为原子晶体>离子晶体>金属晶体>分子晶体,
则SiO2熔点最高,其次为CaO>NaCl,CBr4和CF4都为分子晶体,分子的相对分子质量越大,分子间作用力越强,熔点越高,
则熔点:CBr4>CF4,
固有:SiO2>CaO>NaCl>CBr4>CF4,
故选A.
点评 本题考查晶体的类型与熔沸点的比较,题目难度不大,解答该类题目时要首先判断晶体的类型,晶体类型相同时,要注意晶体结构是否相似,把握影响晶体熔沸点的因素.


科目:高中化学 来源: 题型:选择题
| A. | .用10mL量筒量取7.28mL稀盐酸 | |
| B. | .用托盘天平称量25.50g NaCl | |
| C. | 用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.60mL | |
| D. | 用广泛pH试纸测得某溶液的pH为2.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫是一种黄色晶体,易溶于水 | |
| B. | 钠是一种银白色金属,熔点较高,硬度较大 | |
| C. | 二氧化硫是一种无色、无味的有毒气体 | |
| D. | 二氧化氮石红棕色、有刺激性气味的有毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱、液态氧、碘酒 | B. | 生石灰、白磷、熟石灰 | ||
| C. | 干冰、铁、氯化氢 | D. | 纯碱、氮气、氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去水中的HClO | B. | 紫外线杀菌消毒 | C. | 增加水中含氧量 | D. | 提高水温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
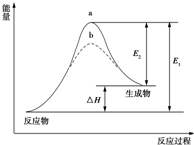
| A. | 该反应的反应热△H=E2-E1 | B. | 该反应为放热反应 | ||
| C. | 催化剂能改变反应的活化能 | D. | 催化剂能改变反应的焓变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com