
| A、平衡时CO的转化率为40% | ||
| B、反应放出的热量为0.08 akJ | ||
C、该温度下的化学平衡常数为
| ||
| D、若将容器的体积压缩为1 L,CO的平衡浓度变为0.12 mol/L |
| 0.08mol |
| 0.2mol |
| ||||
|
| 4 |
| 9 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
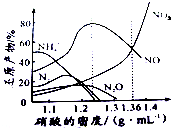 金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有AgCl沉淀生成 |
| B、无AgCl沉淀生成 |
| C、有沉淀生成但不是AgCl |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
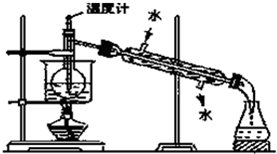
 实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物.某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型.回答下列问题:
实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物.某研究性学习小组欲用如图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com