
| A. | 硫酸氢钠溶于水既有离子键被破坏又有共价键被破坏 | |
| B. | 单质分子中均含共价键 | |
| C. | HF与HBr相比,分子内共价键更强,所以HF沸点更高 | |
| D. | 由不同元素组成的多原子分子里,只存在极性键 |
分析 A.硫酸氢钠溶于水的电离方程式为NaHSO4=Na++H++SO42-,根据电离方程式判断;
B.单原子分子不存在共价键;
C.HF的沸点与氢键有关;
D.不同元素组成的多原子分子里可能存在非极性键.
解答 解:A.硫酸氢钠溶于水的电离方程式为NaHSO4=Na++H++SO42-,所以硫酸氢钠溶于水的过程中既有离子键被破坏又有共价键被破坏,故A正确;
B.单原子分子不存在共价键,如He等,故B错误;
C.HF分子间含有氢键,沸点较高,与共价键无关,故C错误;
D.不同元素组成的多原子分子里可能存在非极性键,如H2O2等,故D错误.
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

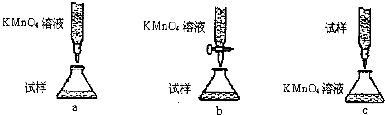
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
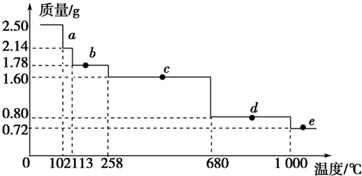
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -74.8kJ.mol-1 | B. | +74.8kJ.mol-1 | C. | -149.6kJ.mol-1 | D. | +149.6kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu | |
| B. | 碳酸钙与盐酸反应:CaCO3+2H+═H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com