
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1molL﹣1CH3COOH溶液中加入少量水,溶液中 ![]() 减小
减小
B.向0.1molL﹣1CH3COONa溶液加入少量水,溶液中 ![]() 不变
不变
C.向盐酸中加入氨水至中性,溶液中 ![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中 ![]() 减小
减小
【答案】B
【解析】解:A.向0.1molL﹣1CH3COOH溶液中加入少量水,加水促进醋酸的电离,氢离子的物质的量增大,醋酸的物质的量减小,所以溶液中 ![]() 增大,故A错误;
增大,故A错误;
B.向0.1molL﹣1CH3COONa溶液加入少量水,水解常数Kh= ![]() 只与温度有关,所以
只与温度有关,所以 ![]() =
= ![]() 保持不变,故B正确;
保持不变,故B正确;
C.向盐酸中加入氨水至中性,溶液中电荷守恒为c(Cl﹣)+c(OH﹣)=c(NH4+)+c(H+),显中性,即c(OH﹣)=c(H+),所以c(Cl﹣)=c(NH4+),故C错误;
D.AgCl、AgBr的饱和溶液中存在AgCl(s)+Br﹣AgBr(s)+Cl﹣,该反应的平衡常数K= ![]() ,向溶液中加入少量AgNO3,K不变,故D错误.
,向溶液中加入少量AgNO3,K不变,故D错误.
故选B.
【考点精析】掌握弱电解质在水溶液中的电离平衡是解答本题的根本,需要知道当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:
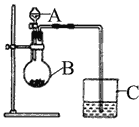
(1)仪器A的名称是________,应盛放下列药品中的__________。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________,应盛放下列药品中的__________。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________,即可说明___________比________酸性强,非金属性________比______强,B中发生反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d原子序数依次增大,b元素的一种同位素可用于考古年代鉴定。甲、乙分别是元素b、d的单质,通常甲为固体,乙为气体,O.OOl mol/L的丙溶液pH=3;W、X、Y均是由这些元素构成的二元化台物,Y是形成酸雨的主要物质之一。上述物质的转化关系如图,下列说法正确的是( )

A. 原子半径:b
B. a、c、d形成的化台物一定是共价化合物
C. W、X、Y中X的熔沸点最高
D. Y、Z均可用排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乙醇的化学性质中,各反应的断键方式可概括如下:

关于下列化学反应类型断键部位描述正确的是
A. 发生酯化反应时断键②
B. 发生催化氧化反应时断②③键
C. 生成乙醚断时①②键
D. 与钠反应时断②键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
B. 常温常压下,17g甲基(—14CH3)所含的中子数9NA
C. 标准状况下,1L己烷充分燃烧后生成的气态产物的分子数为![]() NA
NA
D. 1mol乙酸(忽略挥发损失)与足量的C2H518OH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将cmol/L氨水滴入10mL.0.1mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
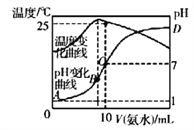
A. c=0.1
B. 25℃时,NH4Cl的水解常数(KA)=(10c-1)×10-7
C. 水的电离程度:B>C>A>D
D. B点:c(NH3·H2O)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)已知在一定温度下,以下三个反应的平衡常数分别为K1、K2、K3: C(s)+CO2(g)2CO(g) K1
CO(g)+H2O(g)CO2(g)+H2(g) K2
C(s)+H2O(g)CO(g)+H2(g) K3
则K1、K2、K3之间的关系是K3=
(2)25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得溶液pH=10,则强酸与强碱的体积比是(溶液混合时体积变化忽略不计) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是将化学能转变为电能的装置。关于下图所示原电池的说法不正确的是

A. Cu为正极,Zn为负极 B. 电子由铜片通过导线流向锌片
C. 正极反应式为2H+ + 2e- ![]() H2↑ D. 原电池的反应本质是氧化还原反应
H2↑ D. 原电池的反应本质是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通人体积为2L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。下列有关推断不正确的是

A. 该反应的化学方程式是3Z![]() 3X+2Y B. t0后.该反应停止进行
3X+2Y B. t0后.该反应停止进行
C. t0时.X的浓度为0.9 mol/L D. t0时,Z的转化率为60%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com