
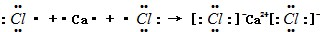 .
. 分析 由Cl-+Ag+═AgCl↓计算XCl2的物质的量,再由M=$\frac{m}{n}$计算其摩尔质量,摩尔质量与相对分子质量的数值相等,原子的质量数为原子的近似相对原子质量,结合该原子原子核内有20个中子,根据质子数=质量数-中子数来计算原子的质子数,利用质子数确定元素在周期表中的位置,并利用质量守恒定律及X的性质来书写反应方程式.
解答 解:(1)由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,
n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.02mol=0.01mol,
则M(XCl2)=$\frac{1.11g}{0.01mol}$=111g/mol,
所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,
质子数=质量数-中子数=40-20=20,即Z=20,A=40
故答案为:20;40;
(2)X为Ca,位于第四周期第ⅡA族,故答案为:第四周期第ⅡA族;
(3)CaCl2的电子式: ,为离子化合物,则CaCl2的形成过程为
,为离子化合物,则CaCl2的形成过程为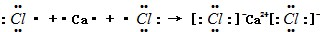 ,
,
故答案为: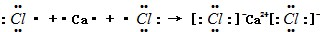 .
.
点评 本题考元素周期表的结构及应用,为高频考点,把握发生的离子反应及原子构成为解答的关键,注意分析与应用能力的考查,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:多选题
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | 在周期表主族元素的最外层电子数等于其主族序数 | |
| D. | 元素周期表中从ⅢB到ⅡB这10个纵行的元素都是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
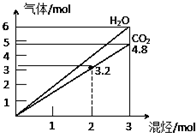 两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O的物质的量随着混合烃物质的量的变化如图所示,则下列对混合烃的判断正确的是( )| A. | ①②④ | B. | ②④⑤ | C. | ②③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘单质 | B. | 碘原子 | C. | 碘元素 | D. | 碘离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com