
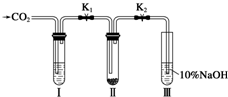
 某课题研究小组的同学在查阅资料时得知,Na2O2与干燥的CO2不能发生反应,当有少量水存在时,Na2O2可与CO2发生反应生成Na2CO3和O2.为了探究“二氧化碳是否在有水存在时才能与过氧化钠反应”.某课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
某课题研究小组的同学在查阅资料时得知,Na2O2与干燥的CO2不能发生反应,当有少量水存在时,Na2O2可与CO2发生反应生成Na2CO3和O2.为了探究“二氧化碳是否在有水存在时才能与过氧化钠反应”.某课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:分析 (1)防止溶液中的水蒸气混入二氧化碳;
(2)X试剂作用是干燥二氧化碳;Y试剂作用是给二氧化碳提供水蒸气;
(3)根据上面的分析可知,试管Ⅲ中的NaOH溶液可以吸收未反应完的CO2以便使木条复燃;
(4)小苏打与稀硫酸反应生成二氧化碳.
解答 解:(1)为了防止溶液中的水蒸气混入二氧化碳,使防止Na2O2受潮,所以在装入Na2O2后,通入CO2前,关闭K1和K2,
故答案为:防止Na2O2受潮;
(2)X试剂作用是干燥二氧化碳,所以X为浓硫酸;Y试剂作用是给二氧化碳提供水蒸气,所以Y为CO2的饱和溶液,以减少二氧化碳的溶解,并提供水蒸气,
故答案为:浓硫酸;CO2的饱和溶液;
(3)根据上面的分析可知,试管Ⅲ中的NaOH溶液可以吸收未反应的二氧化碳,以便使木条复燃,
故答案为:吸收未反应完的CO2以便使木条复燃;
(4)小苏打与稀硫酸生成二氧化碳,大理石与稀硫酸反应生成的硫酸钙是微溶物质,所以选用小苏打与稀硫酸制备二氧化碳,
故答案为:be.
点评 本题考查了过氧化钠与二氧化碳反应的探究实验,为高频考点,侧重于学生的分析、实验能力的考查,题目涉及试剂的选择,注意把握实验的原理,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4+ NO3- CO32- Na+ | B. | Na+ Ba2+ Mg2+ HCO3- | ||
| C. | NO3- Ca2+ K+ Cl- | D. | NO3- K+[Al(OH)4]- H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发、萃取、分液 | B. | 分液、结晶、蒸发 | C. | 过滤、蒸发、萃取 | D. | 萃取、过滤、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 负极发生的反应为:Fe-2e-=Fe 2+ | |
| C. | 正极发生的反应为:2H2O+O2+2e-=4OH- | |
| D. | 钢柱在水下的部分比在空气和水交界出更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数.
化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
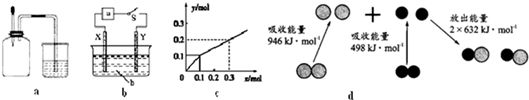
| A. | 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ | |
| D. | 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=-180 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O?H3O++B2- | |
| B. | 电解盐酸:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | NaHCO3的电离:NaHCO3?Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com