
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
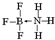 .
.
分析 (1)①Ti是22号元素其原子核外有22个电子,Ti原子失去两个电子生成Ti2+,该离子核外有1s、2s、2p、3s、3p、3d电子,电子占据的最高能级是3d能级,该能级具有的原子轨道数为5;
②BH4-中B原子价层电子对个数是4且不含孤对电子对,根据价层电子对互斥理论判断B原子的杂化方式;
(2)①电子层结构相同的离子,离子半径随着原子序数增大而减小;
②根据表中数据知,M原子核外有2个电子,位于第IIA族,在化合物中呈现+2价,H为-1价,根据化合价判断化学键;
(3)①结构相似的氢化物,含有氢键的物质熔沸点较高;
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,N原子和B原子之间存在配位键;
(4)①非极性分子的溶质极易溶于非极性分子的溶剂;
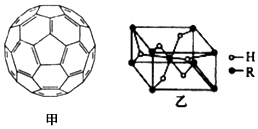
②根据图知,每个C原子含有σ 键个数=$\frac{1}{2}$×3=1.5;
(5)该晶胞中H原子个数=2+4×$\frac{1}{2}$=4,R原子个数=1+8×$\frac{1}{8}$=2,H、R原子个数之比=4:2=2:1;根据密度和摩尔质量计算V=$\frac{m}{ρ}$.
解答 解:(1)①Ti是22号元素其原子核外有22个电子,Ti原子失去两个电子生成Ti2+,所以基态Ti2+中含有的电子数为20;该离子核外有1s、2s、2p、3s、3p、3d电子,电子占据的最高能级是3d能级,该能级具有的原子轨道数为5;
故答案为:20;3d;5;
②BH4-中B原子价层电子对个数是4且不含孤对电子对,根据价层电子对互斥理论知B原子的杂化方式为sp3,
故答案为:sp3;
(2)①电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:Li+<H-,
故答案为:<;
②根据表中数据知,M原子核外有2个电子,位于第IIA族,在化合物中呈现+2价,为Mg元素,H为-1价,该化合物化学键为MgH2,
故答案为:MgH2;
(3)①结构相似的氢化物,含有氢键的物质熔沸点较高,氨气分子和膦分子结构相似,但氨气中含有氢键,导致熔沸点升高,
故答案为:氨气分子之间可以形成氢键;
②NH3容易和分子中有空轨道的BF3反应形成新的化合物,N原子和B原子之间存在配位键,其结构式为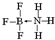 ,
,
故答案为: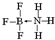 ;
;
(4)①非极性分子的溶质极易溶于非极性分子的溶剂,C60晶体易溶于苯、CS2,C60是非极性分子,故答案为:非极性;
②根据图知,每个C原子含有σ 键个数=$\frac{1}{2}$×3=1.5,1mol该物质中σ 键个数=1.5×60×1mol×NA/mol=90NA,故答案为:90NA;
(5)该晶胞中H原子个数=2+4×$\frac{1}{2}$=4,R原子个数=1+8×$\frac{1}{8}$=2,H、R原子个数之比=4:2=2:1,所以其化学式为H2R,该晶胞体积=$\frac{\frac{M+2}{{N}_{A}}×2}{ρ}$cm3=$\frac{2M+4}{{a{N_A}}}$cm3,
故答案为:H2R;$\frac{2M+4}{{a{N_A}}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、相似相溶原理、氢键、原子核外电子排布等知识点,这些都是高频考点,难点是晶胞计算、价层电子对互斥理论,题目难度中等,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
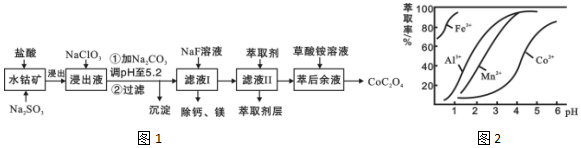
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .用电子式表示D2C的形成过程
.用电子式表示D2C的形成过程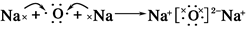 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素C、D、E的最高价氧化物对应水化物的酸性递减 | |
| B. | 元素D、E分别与元素A形成化合物的稳定性:A2D>AE | |
| C. | D、E简单离子的还原性顺序为:D>E | |
| D. | 元素B、D、E的简单离子半径大小为:B>D>E |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强(Pa) | 2×105 | 5×105 | 1×106 |
| 浓度(mol•L-1) | 0.085 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6和C3H8 | B. | C5H10和C6H6 | C. | C2H6O和C2H4O2 | D. | C3H6和C3H8O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com