
【题目】氮化镁(Mg3N2)可用于核废料的回收,常温下为浅黄色粉末,易水解。某兴趣小组拟在实验室里通过氮气和镁粉反应制取少量氮化镁(Mg3N2),制备装置示意图如下。

(1)工业上通常通过______________________获取氮气。
(2)装置A中橡胶管a的作用是______________________。
(3)NaNO2和(NH4)2SO4反应制备氮气的离子方程式______________________。
(4)装置B的作用为______________________。
(5)检验Mg3N2水解生成气体为NH3的方法为:取适量样品放入试管中,滴加蒸馏水,加热试管,_________________________________(填操作与现象)。
(6)为测定产物中Mg3N2纯度,该小组称取4.0g样品加入足量10%NaOH溶液并加热,生成的气体全部用100.00mL 0.500mol·L-1的硫酸溶液吸收。将所得溶液稀释到250.00mL,取25.00mL该溶液,用0.2000mol·L-1NaOH标准溶液滴定过剩的硫酸。重复实验平均消耗NaOH溶液25.25mL。样品中Mg3N2的质量分数为___________(保留一位小数)。滴定过程中若有NaOH溶液溅出,测定结果将___________(填“偏高”或“偏低”)
【答案】分离液态空气 平衡压强,使液体顺利流下(连通管平衡分液漏斗与烧瓶之间的压强)(使分液漏斗中液面上方和烧瓶中液面上方的压强相同) NO2-+NH4+![]() N2↑+2H2O 判断装置是否发生堵塞(调节压强、平衡气压) 湿润的红色石蕊试纸靠近试管口,试纸变蓝(湿润的pH试纸靠近试管口,试纸变蓝) 61.9% 偏低
N2↑+2H2O 判断装置是否发生堵塞(调节压强、平衡气压) 湿润的红色石蕊试纸靠近试管口,试纸变蓝(湿润的pH试纸靠近试管口,试纸变蓝) 61.9% 偏低
【解析】
(1)工业上通常通过分离液态空气获取氮气;
(2)装置A中橡胶管a可使分液漏斗中液面上方和烧瓶中液面上方的压强相同,平衡压强,使液体顺利流下;
(3) NaNO2和(NH4)2SO4反应生成硫酸钠、氮气和水,以此书写离子方程式;
(4)装置B中盛有水,当装置中发生堵塞,长玻璃导管液面会上升;
(5)检验NH3利用氨气溶于水显碱性,用湿润的红色石蕊试纸或湿润的pH试纸检验;
(6) 根据反应关系:Mg3N2~2NH3~H2SO4,H2SO4~2NaOH计算;滴定过程中若有NaOH溶液溅出,则消耗的碱多,中和剩余酸多,则吸收氨气的硫酸的量减小,所得样品中Mg3N2质量减小,测定结果将偏低。
(1)工业上通常通过分离液态空气获取氮气;
故答案为:分离液态空气;
(2)装置A中橡胶管a使分液漏斗中液面上方和烧瓶中液面上方的压强相同,平衡压强,使液体顺利流下;
故答案为:平衡压强,使液体顺利流下;
(3) NaNO2和(NH4)2SO4反应生成硫酸钠、氮气和水,2NaNO2+(NH4)2SO4![]() Na2SO4+ 2N2↑+4H2O,离子方程式为NO2-+NH4+
Na2SO4+ 2N2↑+4H2O,离子方程式为NO2-+NH4+![]() N2↑+2H2O;
N2↑+2H2O;
故答案为:NO2-+NH4+![]() N2↑+2H2O;
N2↑+2H2O;
(4)装置B中盛有水,当装置中发生堵塞,长玻璃导管液面会上升,所以装置B可起到判断装置是否发生堵塞的作用;
故答案为:判断装置是否发生堵塞;
(5)检验NH3利用氨气溶于水显碱性,用湿润的红色石蕊试纸或湿润的pH试纸检验,方法是:取适量样品放入试管中,滴加蒸馏水,加热试管,湿润的红色石蕊试纸靠近试管口,试纸变蓝(或湿润的pH试纸靠近试管口,试纸变蓝);
故答案为:湿润的红色石蕊试纸靠近试管口,试纸变蓝(或湿润的pH试纸靠近试管口,试纸变蓝);
(6) 根据反应关系:Mg3N2~2NH3~H2SO4,H2SO4~2NaOH,
与氢氧化钠溶液反应的硫酸的物质的量:![]() 0.2000mol·L-1
0.2000mol·L-1![]() 25.25
25.25![]() 10-3L=2.525
10-3L=2.525![]() 10-3mol,
10-3mol,
吸收氨气的硫酸的物质的量:0.500mol·L-1![]() 0.1L-2.525
0.1L-2.525![]() 10-3mol
10-3mol![]() =0.02475mol,
=0.02475mol,
则样品中含Mg3N2的物质的量:n(Mg3N2)=n(H2SO4)= 0.02475mol,
则Mg3N2纯度为:![]() 100%=61.9%,
100%=61.9%,
滴定过程中若有NaOH溶液溅出,则消耗的碱多,中和剩余酸多,则吸收氨气的硫酸的量减小,所得样品中Mg3N2质量减小,测定结果将偏低。
故答案为:61.9%;偏低。


科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)===2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)===4NO(g)+6H2O(l) ΔH=c kJ·mol-1
反应8NH3(g)+6NO2(g)===7N2(g)+12H2O(l) ΔH=____kJ·mol-1。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图1所示。写出该图示的总反应化学方程式:______________________。该反应需控制温度,温度过高时氨氮去除率降低的原因是________________________________________________________________________。
 图1
图1 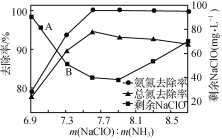 图2
图2

②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图2所示。点B剩余NaClO含量低于点A的原因是____。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是____。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图3所示。
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A、B、C三种固体物质的溶解度曲线。下列叙述错误的是( )

A. t1℃时,三种物质的溶解度大小顺序为C>B>A
B. 当A中混有少量B 时,可用降温结晶的方法提纯A
C. 将A、B、C的饱和溶液从t3℃降温到t2℃,溶液中均有固体析出
D. 若要将N点的A溶液转变为M点的A溶液,可在恒温条件下采用蒸发溶剂法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)铁屑加入硝酸银溶液中反应的离子方程式为______。
(2)醋酸(CH3COOH)与烧碱溶液反应的离子方程式为______。
(3)NaHSO4是一种______(填“酸、碱、盐”),向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性时,该反应的离子方程式为_____。
(4)实验室制备少量Fe(OH)3胶体的化学方程式为______。
(5)配平下列方程式:____SO32-+___IO3-+___H+=___SO42-+___I2+___H2O,______
(6)一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O,从而可知在RO3n-中,元素R的化合价是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
A. 增加Ni的量可提高CO的转化率,Ni的转化率降低
B. 缩小容器容积,平衡右移,△H减小
C. 反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D. 当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应为:4M+nO2+2nH2O=4M(OH)n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 比较Mg、Al、Zn三种金属-空气电池,Mg-空气电池的理论比能量最高
B. 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
C. 电池放电过程的正极反应式:O2+2H2O+4e-=4OH-
D. 多孔电极可提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,根据下列信息回答问题:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
④ 2CO(g)+O2(g)=2CO2(g) △H =-566.0 kJ·mol-1

(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3kJ。
(2)已知H-H的键能436kJ/mol O=O的键能496kJ/mol H-O的键能463kJ/mol,根据上述数据(能否)______________计算②的反应热
(3)若1molCH4 气体完全燃烧生成CO2气体和水蒸气, 放出的热量______(填“大于”“等于”或“小于”)890. 3kJ。
(4)计算CO2(g)+4H2( g ) =CH4( g ) +2H2O( l )的焓变△H=__________。
(5)甲烷与CO2可用于合成水煤气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4完全反应可释放15.46kJ的热量,若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,
①体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。

②相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为________(整数比)
(6)①石墨中C-C键键能________金刚石中C-C键键能。(填“大于” “小于”或“等于”)。
②写出石墨转化为金刚石的热化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)![]() Fe(s)+CO2(g)△H>0。试回答下列问题:
Fe(s)+CO2(g)△H>0。试回答下列问题:
(1)写出该反应的平衡常数表达式___________。
(2)升高温度,该反应的平衡常数K值将________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将______( 填“增大”、“减小”、“不变”)。
(3)已知1100℃时该反应的平衡常数K=0.263.在该温度测得高炉中c(CO2)=0.025mol·L﹣1,c(CO)=0.1mol·L﹣1,此时该反应的化学反应速率是v(正)________ v(逆)(填“>”、“<”、“=”)。
(4)保持高炉温度为1100℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值_____0.263(填”>”、“<”、“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com