

| A. | 该化合物的分子式为C17H17N2O6 | |
| B. | 该化合物的分子中含有三种不同的官能团 | |
| C. | 该化合物的不饱和度为10 | |
| D. | 该化合物能发生水解反应、聚合反应、取代反应、消去反应 |
分析 A.根据结构简式确定分子式;
B.该物质中含有酯基、碳碳双键、硝基和氨基;
C.苯环的不饱和度是4、碳碳双键的不饱和度是1、酯基的不饱和度是1、硝基的不饱和度是2;
D.酯基能发生水解反应、碳碳双键能发生聚合反应.
解答 解:A.根据结构简式确定分子式为C17H18N2O6,故A错误;
B.该物质中含有酯基、碳碳双键、硝基和氨基四种官能团,故B错误;
C.苯环的不饱和度是4、碳碳双键的不饱和度是1、酯基的不饱和度是1、硝基的不饱和度是2,所以该有机物分子的不饱和度是10,故C正确;
D.酯基能发生水解反应、碳碳双键能发生聚合反应,该分子中不含醇羟基或卤原子,所以不能发生消去反应,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃、酯基性质,易错选项是C.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
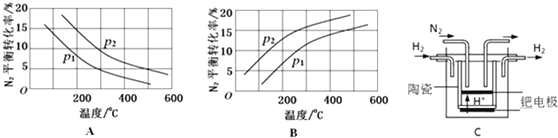
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 操作或现象 |
| A | 检验甲酸溶液中是否含有甲醛 | 向溶液中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,有红色沉淀产生 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验蔗糖是否已水解 | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水浴加热 |
| D | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向上层清液中加稀HNO3酸化,再滴加AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
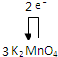 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
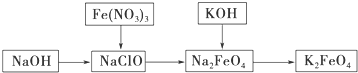
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 一定条件下6.4g S02与足量氧气反应生成S03,转移电子数小于0.2 NA | |
| C. | lmol羟基(一OH)与17gNH3所含电子数都为NA | |
| D. | 适量铜粉溶解于1 L 0.5mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜晶体、雾 | B. | 水煤气、氢氧化铁胶体 | ||
| C. | 盐酸、磷酸钙 | D. | 玻璃、含Fe为70%的氧化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用乙醇汽油作为汽车的燃料 | |
| B. | 洗涤衣物时使用无磷洗衣粉等洗涤剂 | |
| C. | 尽量减少塑料购物袋的使用 | |
| D. | 加大石油、煤炭的开采速度,增加化石的供应量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com