
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO 部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、
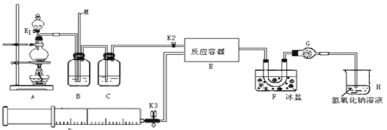
试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式__________。
(2)装置B的作用是 ①__________,②____________。
(3)若用A装置制取NO气体,B中应该盛放_________。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为___。
(5) 简述检查A、B、C所组成的实验装置气密性的操作_________。
(6)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与________________同时通入NaOH溶液中。
(7)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明 HNO2是弱酸:____________。(仅提供的试剂:1 molL-1HCl、 1 molL-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0 g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,用0.20 molL-1 AgNO3标准溶液滴定至终点,根据表中所给信息,应选用____________做指示剂,滴定终点的现象是______。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3 ×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为________。
【答案】MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去挥发的HCl气体 平衡容器内压强 H2O 2:1 向B和C中加入适量水,使瓶内长导管插入液面以下,分液漏斗中加入适量水后,将漏斗上口活塞打开,再旋转活塞,当有少量水流下后,水不再流下,即说明装置气密性好 O2 用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸上,试纸变蓝,说明HNO2是弱酸 K2CrO4溶液 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化 87.3%
Mn2++Cl2↑+2H2O 除去挥发的HCl气体 平衡容器内压强 H2O 2:1 向B和C中加入适量水,使瓶内长导管插入液面以下,分液漏斗中加入适量水后,将漏斗上口活塞打开,再旋转活塞,当有少量水流下后,水不再流下,即说明装置气密性好 O2 用玻璃棒蘸取NaNO2溶液,点在红色石蕊试纸上,试纸变蓝,说明HNO2是弱酸 K2CrO4溶液 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化 87.3%
【解析】
实验室利用浓盐酸和二氧化锰混合加热制氯气,并利用B中饱和食盐水除去挥发的HCl、C中浓硫酸干燥氯气;N2和Cl2一起通E中在常温下生成ClNO,在装置F中经冷却后液化并收集,尾气用氢氧化钠溶液吸收,据此分析解题。
(1)装置A中利用浓盐酸和二氧化锰混合加热制氯气,发生反应的离子反应方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)A中制得的氯气混合挥发的HCl,则装置B中饱和食盐水可除去挥发的HCl气体,同时长玻璃管还能平衡B中压强,起稳压作用;
(3) 用A制取NO,A中Cu和稀硝酸反应生成NO,因为硝酸具有挥发性,所以得到的NO中含有硝酸,B中盛放物质能吸收硝酸,稀硝酸溶于水且NO不溶于水,所以B中可以盛放H2O;
(4) 二者反应方程式为Cl2+2NO=2NOCl,二者的流速之比等于其计量数之比即可,则理论上通入NO和Cl2两种气体的流速比为2:1;
(5)检查A、B、C所组成的实验装置气密性的操作是向B和C中加入适量水,使瓶内长导管插入液面以下,分液漏斗中加入适量水后,将漏斗上口活塞打开,再旋转活塞,当有少量水流下后,水不再流下,即说明装置气密性好;
(6)尾气中的Cl2能溶于NaOH,而NO不与水或碱反应,则NO不能被完全吸收,NO和O2反应生成二氧化氮,二氧化氮和水反应生成硝酸,所以可以通入O2;
(7)①若亚硝酸为弱酸,则亚硝酸盐水解呈若碱性,即使用玻璃棒蘸取NaNO2溶液涂抹于红色的石蕊试纸上,若试纸变蓝,则说明亚硝酸为弱酸;
②AgI、AgBr比AgCl更难溶于水,选用KBr或KI作指示剂,最先生成的沉淀可能是AgBr或AgI,则选择K2CrO4溶液为指示剂,滴定终点的现象是:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化,说明反应达到终点;消耗0.20 molL-1AgNO3溶液的体积为20.00ml,其物质的量为0.20 molL-1×0.02L=0.004mol,根据原子守恒,亚硝酰氯(ClNO)的质量分数为 ×100%=87.3%。
×100%=87.3%。


科目:高中化学 来源: 题型:
【题目】化合物M是一种香料,可采用油脂与芳香烃(含苯环的烃)为主要原料,按下列路线合成:
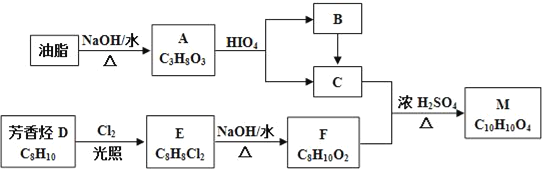
已知:①RX![]() ROH
ROH
②E分子中只有两种不同化学环境的H原子
③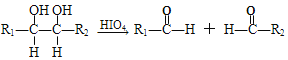
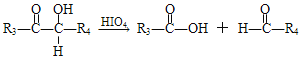
(R1、R2、R3与R4可能是氢、烃基或其他基团)
(1)A中官能团的名称是___,D→E的反应类型为___。
(2)E的结构简式为___。
(3)C+F→M的化学方程式____。
(4)下列化合物中属于F的同分异构体的是____。
a.![]()
b.![]()
c.![]()
d.CH2=CH﹣CH=CH﹣CH=CH﹣CH2COOH
(5)写出从Br﹣CH2CH2﹣Br→HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
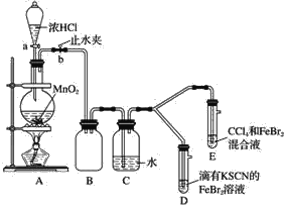
(1)①装置A中发生反应的离子方程式是______________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:

①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加____________溶液,若溶液颜色________,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属元素在化学中具有重要地位,请回答下列问题:
(1)下图的氮循环是生态系统物质循环的重要部分,人类活动加剧了氮循环中的物质转化。
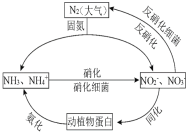
①N在元素周期表中的位置_________,![]() 的立体构型__________。
的立体构型__________。
②反硝化过程中,CH3OH可作为反应的还原剂,1mol还原剂失去6mol电子,被氧化为两种常见离子。请将该反应的离子方程式补充完整:__CH3OH+__![]()
![]() ___+___+___+___ 。
___+___+___+___ 。
(2)砷及其化合物有重要的用途。
③砷(As)简化的电子排布式___,AsH3的熔沸点比NH3的 ___(填“高”或“低”),原因是____。
④雌黄(As2S3)在我国古代常用作书写涂改修正液。分子结构如下图,则砷原子的杂化方式为_____。
⑤砷化镓(GaAs)的熔点为1238℃,密度为ρ g·cm-3,其晶胞结构如图所示。

距Ga原子最近且等距的As原子个数为____,GaAs的摩尔质量为M g·mol-1,阿伏加德罗常数值为NA,则该晶胞边长为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
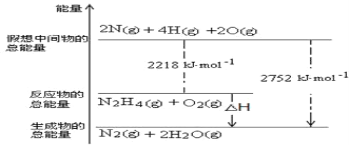
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为__________。
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/molL-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/molL-1min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲____________V丙,平衡常数K丙_________K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)H2NCOONH4(氨基甲酸铵)(l) △H1 ,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________。
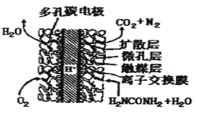
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol SO2与2 mol O2的混合气分别置于容积相等的甲、乙两容器中,甲是恒压容器,乙是恒容容器。发生反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
2SO3(g);△H<0,在相同温度下,使其均达到平衡状态。下列说法正确的是
A. SO3体积分数:甲 > 乙
B. 平衡常数:甲>乙
C. 反应放出的热量:甲<乙
D. 保持容积不变,使乙容器升温可以使甲乙容器中SO2物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学多米诺实验”是只需控制第一个反应,就能使若干化学实验依次发生,如图所示。已知:①Cu2++4NH3H2O=4H2O+[Cu(NH3)4]2+(该反应产物可作为H2O2的催化剂);②已知装置A、C中所用硫酸的浓度相同,装置B、D中所用金属锌的质量完全相同
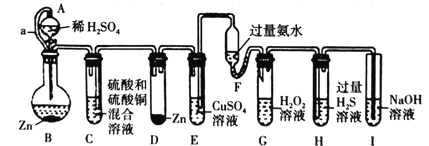
下列说法错误的是( )
A.该实验成功的关键条件是整套装置的气密性良好
B.因为形成原电池,所以装置D中生成氢气的反应速率一定大于B
C.导管a的作用是平衡A和B内气压
D.装置H中出现浅黄色浑浊,可证明非金属性:O>S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对物质结构的探索永无止境。回答下列问题:
(1)碳硼烷酸[化学式为H(CHB11Cl11)是目前世界上已知的最强酸,但腐蚀性很小,可以作为无污染的酸催化剂。现代化学中常利用的___特征谱线来鉴定元素。组成碳硼烷酸的4种元素中,基态原子中未成对电子数最多的是___(填电子排布式)。
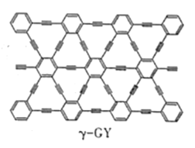
(2)石墨炔是我国科学家在2010年首次制得一种新的碳的同素异形体,其中一种结构如图所示,石墨炔中碳原子的杂化类型为___。
(3)硼元素具有缺电子性。自然界中含硼元素的钠盐是—种天然矿藏,其化学式写作Na2B4O710H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]8H2O。其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___(填字母)。
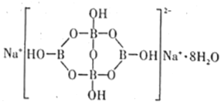
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(4)镓与硼元素处于同一主族,GaN是制造5G芯片的材料,可发出紫外光。
①科学家合成了一种阳离子为“N5n+”其结构是对称的,5个N排成“V”形,每个N原子的最外层都达到8电子稳定结构、且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,N8中阴离子的空间构型为___,写出一种与其互为等电子体的分子___(填化学式)。
②Ga和As两种元素电负性相差不大,能形成化合物GaAs。GaAs的熔点为1238℃,其晶胞结构如图所示。
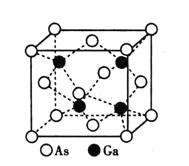
已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为___,GaAs的熔点___(填“高于”或“低于”)GaN,其理由是___。若Ga和As的原子半径分别为rGa和rAs,则GaAs晶胞中原子的体积占晶胞体积的百分率为___(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以合成氨(低温变换的)废催化剂(主要含Zn、Cu的单质和氧化物)为原料制取ZnCO3·2Zn(OH)2和Cu2O,其实验流程如图:
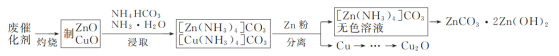
(1)“灼烧”时,需用的硅酸盐质仪器除玻璃棒、酒精灯外,还有___和___。
(2)“浸取”时,生成[Zn(NH3)4]CO3的离子方程式为___。
(3)加“Zn粉”时,为使Zn粉不过量太多{已知:溶液中[Cu(NH3)4]2+呈深蓝色},合适的操作方法及依据的现象是___;分离出的铜粉中混有少量Zn,提纯铜粉的方案是__。
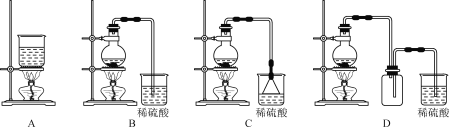
(4)已知反应:[Zn(NH3)4]2+![]() Zn2++4NH3,K=3.5×10-10,由[Zn(NH3)4]CO3溶液制取ZnCO3·2Zn(OH)2,可采用的装置是___(填字母)。
Zn2++4NH3,K=3.5×10-10,由[Zn(NH3)4]CO3溶液制取ZnCO3·2Zn(OH)2,可采用的装置是___(填字母)。
(5)设计以提纯后的铜粉为原料制取Cu2O的实验方案:向烧杯中加入计量的铜粉,__,静置、冷却、过滤、水洗及干燥[已知在约50℃时,发生反应:Cu+H2O2+H2SO4=CuSO4+2H2O。实验中必须使用的试剂:稀硫酸、葡萄糖溶液、10%的NaOH溶液和15%的H2O2溶液]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com