
【题目】研究 CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的 CO2 主要以 4 种无机碳形式存在,其中 HCO3-占 95%,写出 CO2溶于水产生 HCO3-的方程式: ___________、___________。
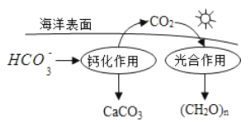
(2)在海洋循环中,通过如图所示的途径固碳, 写出钙化作用的离子方程式__________。
(3)海水中溶解无机碳占海水总碳的 95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:①气提、吸收 CO2 。用 N2 从 H2SO4溶液酸化后的 Z mL海水中吹出 CO2 并用碱液吸收(装置如图)
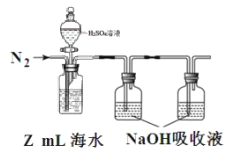
②滴定。将吸收液吸收的无机碳转化为 NaHCO3,再用x mol/L盐酸滴定,消耗y mL盐酸,则海水中溶解无机碳的浓度=________mol/L。
(4)利用下图所示装置从海水中提取 CO2,有利于减少环境温室气体含量。
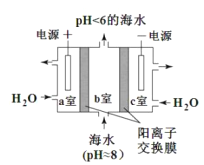
①提取CO2 的原理:_____(填 a 或 b)室产生的 H+ 通过阳离子膜进入b 室,发生反应:。 ________。
②用该装置产生的物质处理 b 室排出的海水,合格后排回大海。处理至合格的具体方法是__________。
【答案】 CO2+H2O![]() H2CO3 H2CO3
H2CO3 H2CO3![]() HCO3-+H+ Ca2++2HCO3-= CaCO3↓+CO2↑+H2O xy/z a HCO3-+H+=CO2↑+H2O 用c 室排除的碱液将从b 室排出的酸性海水调节至接近装置入口海水的pH
HCO3-+H+ Ca2++2HCO3-= CaCO3↓+CO2↑+H2O xy/z a HCO3-+H+=CO2↑+H2O 用c 室排除的碱液将从b 室排出的酸性海水调节至接近装置入口海水的pH
【解析】(1)二氧化碳溶于水生成的碳酸为弱酸,部分电离生成碳酸氢根,有关方程式为:CO2+H2O![]() H2CO3、H2CO3
H2CO3、H2CO3![]() HCO3-+H+;(2)反应物中含有碳酸氢根,生成物为碳酸钙,依据元素守恒以及电荷守恒得出方程式为:Ca2++2HCO3-= CaCO3↓+CO2↑+H2O;(3)此反应原理为:NaHCO3+HCl=NaCl+CO2↑+H2O,即碳酸氢钠与盐酸的物质的量之比为1:1,那么海水中碳酸氢钠的浓度为c,体积均为mL,依据题意有c×z=xy,解c=
HCO3-+H+;(2)反应物中含有碳酸氢根,生成物为碳酸钙,依据元素守恒以及电荷守恒得出方程式为:Ca2++2HCO3-= CaCO3↓+CO2↑+H2O;(3)此反应原理为:NaHCO3+HCl=NaCl+CO2↑+H2O,即碳酸氢钠与盐酸的物质的量之比为1:1,那么海水中碳酸氢钠的浓度为c,体积均为mL,依据题意有c×z=xy,解c=![]() ;(4)a室:2H2O-4e-=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O;②c室:2H2O+2e-=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH。
;(4)a室:2H2O-4e-=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O;②c室:2H2O+2e-=2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调节至装置入口海水的pH。


科目:高中化学 来源: 题型:
【题目】下列表述方式错误的是( )
A.Fe的基态原子外围电子排布图: ![]()
B.氯化钠的分子式:NaCl
C.N的基态原子核外电子排布式:1S22S22p3
D.HC1O的结构式:H﹣O﹣Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知: ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) Δ H=+93.0 kJ·mol-1
②CH3OH(g)+1/2 O2(g)=CO2(g)+2H2(g) Δ H=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) Δ H=-38.19 kJ·mol-1
则表示 CH3OH 的燃烧热的热化学方程式为___________ 。
(2)在一定条件下用CO和H2合成 CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2 L恒容密闭容器中充入1mol CO和2mol H2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。
CH3OH(g),在2 L恒容密闭容器中充入1mol CO和2mol H2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。

回答下列问题:
①该反应的反应热 Δ H________ 0(填“>” 或“<” ),压强的相对大小与p1_______ p2(填“>” 或“<” )。
②压强为 p2,温度为 300℃时,该反应的化学平衡常数的计算式为K=_______(只列算式不计算结果)。
③下列各项中,不能说明该反应已经达到平衡的是_______。
A.容器内气体压强不再变化
B.υ (CO):υ (H2)=1:2
C.容器内的密度不再变化
D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
④某温度下,在保证 H2 浓度不变的情况下,增大容器的体积, 平衡_______。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲俗称苛性钠,由X、Z、Q三种元素组成。医学中常用QR溶液配制生理盐水。化合物乙由X、R两种元素组成。请回答下列问题:
(1)Q的离子结构示意图为__。
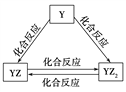
(2)Y元素的单质及其化合物能发生如上图所示的转化,则Y元素为___(填元素符号)。在甲溶液中通入足量YZ2气体,写出该反应的离子方程式:______。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为_______。
②Q、W两种元素金属性的强弱为Q____W(填“<”或“>”),下列表述中能证明这一事实的是____(填序号)。
a.Q单质的熔点比W单质的低
b.W的原子序数大
c.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
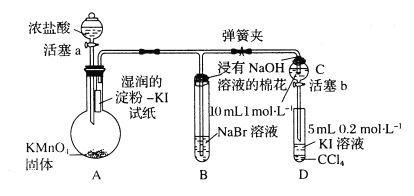
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器己略去,气密性已检验)。
实验过程:
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为红棕色时,关闭活塞a。
IV.……
(1)A中产生黄绿色气体的化学反应方程式是___________。
(2)验证氯气的氧化性强于碘的实验现象是___________。
(3)B中溶液发生反应的离子方程式是___________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作是___________,现象是___________。
(5)过程III实验的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
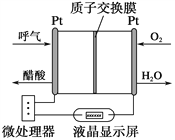
A. 该电池的负极反应式为CH3CH2OH+3H2O12e===2CO2↑+12H+
B. 该电池的正极反应式为O2+4e+4H+===2H2O
C. 电流由O2所在的铂电极经外电路流向另一电极
D. 微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com