
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
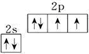 ,氧的第一电离能在同周期元素中由大到小排第4位.
,氧的第一电离能在同周期元素中由大到小排第4位.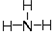 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
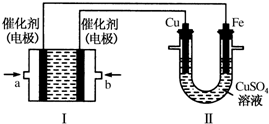
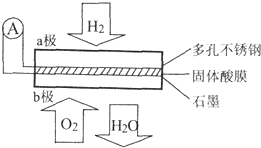 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )| A. | H+由b极通过固体酸电解质传递到a极 | |
| B. | b极上的电极反应式为:O2+4H++4e-=2H2O | |
| C. | 每转移0.4 mol电子,生成3.6g水 | |
| D. | 电池工作时,化学能主要转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
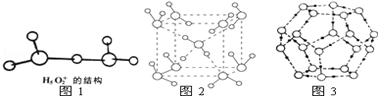
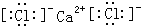 .
.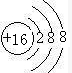 ;D与E能形成一种类似与CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的结构式为S=C=S;化学键类型为极性共价键.
;D与E能形成一种类似与CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的结构式为S=C=S;化学键类型为极性共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a:b | B. | a:2b | C. | a:(2a+2b) | D. | a:(a+2b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>HF>H2S | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 离子半径:Cl->S2->K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出来的c(H+)=1.0×10-12 mol/L | |
| B. | c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | 与同浓度的盐酸分别加水稀释10倍:pH(醋酸)>pH(盐酸) | |
| D. | 在醋酸溶液中加入少量醋酸钠固体,能抑制醋酸的电离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com