
 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.| 氯气,点燃 |
| ① |
| 少量水 |
| ② |
| 氨气 |
| ③ |
| 氨气 |
| ④ |
| H2S |
| ⑤ |


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验用品 | 溶液 体积* | 溶液温度 | 中和热(△H) | ||
| t1 | t2 | ||||
| a | 0.55 mol?L-1 NaOH溶液 | 50 mL | 20℃ | 23.3℃ | |
| 0.5 mol?L-1 HCl溶液 | 50 mL | ||||
| b | 0.55 mol?L-1 NaOH溶液 | 50 mL | 20℃ | 23.5℃ | |
| 0.5 mol?L-1 HCl 溶液 | 50 mL | ||||
. |
| △t |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SCl2、PCl3、CO2 |
| B、AsH3、BF3、BeCl2 |
| C、XeF2、PCl5、ClO2 |
| D、H2SO3、CO2、BrF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、研发可降解高分子材料,减少塑料制品的使用 |
| B、倡导“低碳经济”,减少对化石燃料的依赖 |
| C、通过“静电除尘”、“燃煤固硫”和“汽车尾气催化净化”提高空气质量 |
| D、采用露天焚烧或深埋的方法处理所有垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
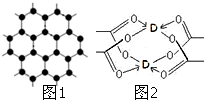
 ,下列说法正确的是( )
,下列说法正确的是( )| A、该有机物分子式为:C10H8O6 |
| B、分子中最多有9个碳原子共平面 |
| C、该有机物可发生取代反应、还原反应,不能发生银镜反应 |
| D、1 mol该有机物分别与足量Na、NaOH溶液、NaHCO3溶液完全反应,消耗Na、NaOH、NaHCO3的物质的量分别为3mol、4mol、1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com