
| A、金属键没有饱和性和方向性 |
| B、金属键中的电子属于整块金属 |
| C、将铁制品做成炊具,金属键没有被破坏 |
| D、金属导电的过程实质就是金属键被破坏的过程 |


科目:高中化学 来源: 题型:
| 烧杯号 | c(CH3COOH)(mol.L-1) | c(H+) | Ka | a |
| 1 | 0.1000 | 1.34×103 | ||
| 2 | 0.0500 | 9.48×103 | ||
| 3 | 0.0100 | 4.24×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述错误的是( )
现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50mL).下列叙述错误的是( )| A、实验的环境温度低于22℃ |
| B、P点的混合溶液的pH=7 |
| C、混合溶液的导电能力:M>N |
| D、若将CH3COOH改为HCl,P点温度高于28℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 |
| ① |
| HF |
| ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 |
| B、反应①中,NaClO是氧化剂 |
| C、反应①为氧化还原反应,反应②为复分解反应 |
| D、若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度相同,体积相同的O2和N2 |
| B、质量相等,密度不等的N2和CO |
| C、体积相等,密度相等的CO和C2H4 |
| D、压强相同、体积相同的N2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ NO3- AlO2- SO42- |
| B、Na+ NO3- SiO32- K+ |
| C、K+ Cl- AlO2- CO32- |
| D、Na+ Cl- HCO3- Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序 号 | 实验内容 | 实验目的 |
| A | 室温下,使用pH计分别测定浓度均为0.1mol/L NaClO溶液和CH3COONa溶液的PH | 比较HClO和 CH3COOH的酸性 强弱 |
| B | 将FeCl3溶液分别滴入无色液体苯、CCl4、汽油、AgNO3溶液、Na2S溶液、NaCl溶液、Na2CO3溶液 | 鉴别物质 |
| C | 向0.1mol/L AgNO3溶液中滴加0.1mol/L NaCl溶液,至不再有白色沉淀生成,再向其中滴入0.1mol/L KI溶液,观察沉淀颜色变化 | 比较AgCl与AgI溶解度的相对大小 |
| D | 向含有少量FeCl3的MgCl2酸性溶液中加入Mg(OH)2,加热并搅拌,过滤. | 除去MgCl2酸性溶液含有的少量FeCl3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
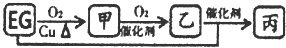 (无机反应物、生成物均已略去):
(无机反应物、生成物均已略去):| Br2(CCl4) |
| NaOH/H2O |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com