
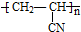 )混合物制作而成的复合材料.工业上用氧化铝电解冶铝的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;聚丙烯腈单体分子中位于同一平面的原子数目最多为7个.
)混合物制作而成的复合材料.工业上用氧化铝电解冶铝的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;聚丙烯腈单体分子中位于同一平面的原子数目最多为7个.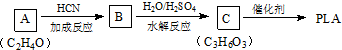
 .
. 分析 (1)①(I)2Ni3S2(s)+7O2 (g)═6NiO(s)+4SO2(g)△H1=akJ•mol-1
(II)Ni3S2(s)+4NiO(s)═7Ni(s)+2SO2(g)△H2=bkJ•mol-1
由盖斯定律可知,$\frac{(I)×2+(II)×3}{7}$得到Ni3S2(s)+2O2(g)═3Ni(s)+2SO2(g);
②电解Ni3S2粗品精炼Ni的反应为:Ni3S2 $\frac{\underline{\;电解\;}}{\;}$3Ni+2S,阴极上得到电子生成Ni,阳极上S失去电子生成S;
(2)工业上用氧化铝电解冶铝,还生成氧气;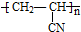 的单体为CH2=CHCN,双键为平面结构、三键为直线结构,且直接相连;
的单体为CH2=CHCN,双键为平面结构、三键为直线结构,且直接相连;
(3)以A为原料合成PLA,PLA为聚乳酸,C为CH3CHOHCOOH,则B为CH3CHOHCN,A为CH3CHO,以此来解答.
解答 解:(1)①(I)2Ni3S2(s)+7O2 (g)═6NiO(s)+4SO2(g)△H1=akJ•mol-1
(II)Ni3S2(s)+4NiO(s)═7Ni(s)+2SO2(g)△H2=bkJ•mol-1
由盖斯定律可知,$\frac{(I)×2+(II)×3}{7}$得到Ni3S2(s)+2O2(g)═3Ni(s)+2SO2(g),△H=$\frac{2a+3b}{7}$kJ/mol,
故答案为:$\frac{2a+3b}{7}$;
②电解Ni3S2粗品精炼Ni的反应为:Ni3S2 $\frac{\underline{\;电解\;}}{\;}$3Ni+2S;用NiCl2溶液作电解液,电解时阴极上主要的电极反应式为Ni2++2e-=Ni,阳极上主要的电极反应式为Ni3S2-6e-=3Ni2++2S,
故答案为:Ni2++2e-=Ni;Ni3S2-6e-=3Ni2++2S;
(2)工业上用氧化铝电解冶铝的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;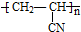 的单体为CH2=CHCN,双键为平面结构、三键为直线结构,且直接相连,所有原子共面,则聚丙烯腈单体分子中位于同一平面的原子数目最多为7个,
的单体为CH2=CHCN,双键为平面结构、三键为直线结构,且直接相连,所有原子共面,则聚丙烯腈单体分子中位于同一平面的原子数目最多为7个,
故答案为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;7;
(3)以A为原料合成PLA,PLA为聚乳酸,C为CH3CHOHCOOH,则B为CH3CHOHCN,A为CH3CHO,
①由上述分析可知A的结构简式为CH3CHO,故答案为:CH3CHO;
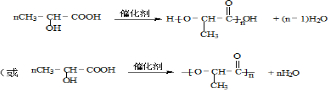
②C→PLA的反应类型为缩聚反应,反应为 ,
,
故答案为:缩聚反应; .
.
点评 本题考查较综合,涉及有机物的合成、结构与性质、反应热与焓变、电解等,为高频考点,把握有机物合成流程中的反应、盖斯定律的应用、电极反应的书写等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 能生成碱的金属元素都在ⅠA族 | |
| B. | 稀有气体元素原子的最外层电子数为2或8 | |
| C. | 原子序数为14的元素位于元素周期表的第3周ⅥA族 | |
| D. | 元素周期表有18个纵行,分列16个族,即7个主族、8个副族和1个0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NH3•H2O的pH小于13 | |
| B. | 0.1 mol•L-1 NH4Cl的pH小于7 | |
| C. | 相同条件下,浓度均为0.1 mol•L-1 NaOH溶液和氨水,氨水的导电能力弱 | |
| D. | 0.1 mol•L-1 NH3•H2O能使无色酚酞试液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H20)/mol | 0.60 | 0.50 | 0.44 | 0.40 | 0.40 |
| n(CO)/mol | 0.40 | 0.30 | 0.24 | 0.20 | 0.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2是还原剂 | B. | 生成1个N2时转移的电子数为6个 | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的 CH3COOH 与 KOH 任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 在滴有酚酞溶液的氨水里,加入盐酸至恰好呈无色,则此时溶液的 pH=7 | |
| C. | 浓度均为 0.1 mol/L 的氨水和氯化铵溶液,水电离出的 c(H+)前者大于后者 | |
| D. | 常温下 pH 为 5 的盐酸溶液稀释 1000 倍后,pH 等于 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com