
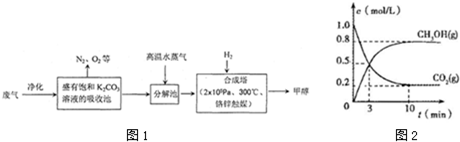
分析 (1)根据工艺流程可知,合成塔内反应是氢气与二氧化碳反应生成甲醇和水;
工业生产条件选择要考虑转化率、反应速率、对催化剂的影响、材料、成本等多方面综合考虑;
(2)从合成塔出来的主要为甲醇与水的混合液,甲醇与水互溶,沸点相差大;
(3)由图可知,10min达平衡,根据v=$\frac{△c}{△t}$计算v(CH3OH)反应速率之比等于化学计量数之比计算氢气的反应速率;
平衡向正反应移动,可以增大n(CH3OH)/n(CO2)的值;
(4)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol,
②H2 (g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol,根据盖斯定律构造目标热化学方程式.
解答 解:(1)合成塔中的反应是二氧化碳和氢气在一定条件下可生成甲醇和水,其方程式为:CO2+3H2$\stackrel{一定条件}{→}$CH3OH+H2O;
温度影响催化剂的活性,除考虑温度对反应速率的影响外,还主要考虑了催化剂的催化活性,
故答案为:CO2+3H2$\stackrel{一定条件}{→}$CH3OH+H2O;催化剂的催化活性;
(2)分离沸点相差比较大,互溶的液体,可以用蒸馏的方法进行分离,
故答案为:C;
(3)由图可知,10min达平衡,平衡时甲醇的浓度为0.8mol/L,
所以v(CH3OH)=$\frac{0.8mol/L}{10min}$=0.08mol/(L•min),反应速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.08mol/(L•min)=0.24mol/(L•min).
增大H2的用量、减少生成H2O 的量等,平衡右移,可以增大n(CH3OH)/n(CO2)的值,
故答案为:0.24mol/(L•min);增大H2的用量等;
(4)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol,
②H2 (g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol,
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式可
根据盖斯定律②×4-①得CO2(g)+4H2 (g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol,
故答案为:CO2(g)+4H2 (g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol.
点评 本题以研究二氧化碳对环境的影响为背景,考查分析图示及书写方程式、化学反应速率计算、热化学方程式书写等,解题时首先要根据流程图明确物质的制备过程,试题有利于培养学生的分析、理解能力及计算能力.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
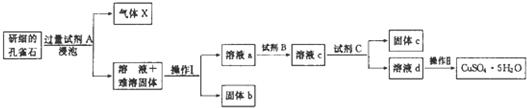
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如图实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
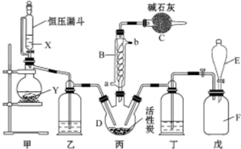 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.
磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量 | |
| B. | 大量排放SO2或CO2都会导致酸雨的形成 | |
| C. | 采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体 | |
| D. | 利用清洁能源如太阳能、潮汐能、风能来发电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com