
| A. | 容器内压强是开始时的1.5倍 | |
| B. | 容器内A、B、C物质的量浓度之比为2:2:1 | |
| C. | 单位时间消耗0.2 mol A 同时生成0.1 mol C | |
| D. | 容器内各物质的浓度不随时间变化 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、容器内压强是开始时的1.5倍,说明平衡时物质的量为3mol,所以反应物完全转化,可逆反应不可能完全转化,故A错误;
B、当体系达平衡状态时,容器内A、B、C物质的量浓度之比可能为2:2:1,也可能不是,不能说明达平衡状态,故B错误;
C、单位时间消耗0.2 mol A 同时生成0.1 mol C,都体现的是正向反应,未说明正与逆的关系,故C错误;
D、容器内各物质的浓度不随时间变化,说明正逆反应速率相等,达平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
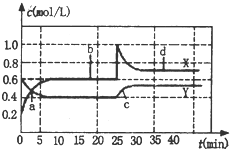 已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )| A. | 图中共有两条曲线X和Y,其中曲线X表示 NO2浓度随时间的变化 | |
| B. | a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d | |
| C. | 若要达到与d相同的状态,在25min时还能采取的措施是适当缩小容器体积 | |
| D. | 反应进行至25min时,曲线发生变化的原因是加入0.4 mol N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
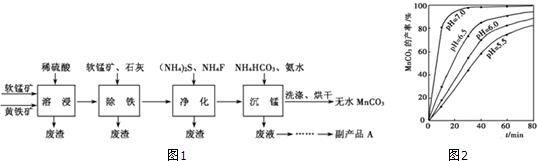
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时OH-向正极移动 | B. | 放电时正极上有氢气生成 | ||
| C. | 水既是氧化剂又是溶剂 | D. | 总反应为:2Li+2H2O═2LiOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
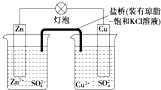
| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 盐桥中的K+移向ZnSO4溶液 | ||
| C. | 在外电路中,电流从负极流向正极 | D. | 电池反应为:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯(C2H4)和环丁烷(C4H6)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体中含有的原子数为6NA | |
| D. | 常温常压下,22.4L 氯气与足量镁粉充分反应,生成氯化镁1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
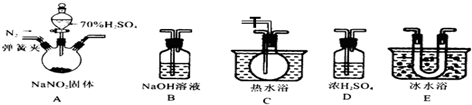
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一原子中,形状相同的原子轨道(即能级)的能量相同 | |
| B. | 同一原子中的2p能级上 的电子的运动状态完全相同 | |
| C. | 多电子原子中,核外电子的运动遵循能量最低原理 | |
| D. | 多电子原子中,每个能层(即电子层)上电子的能量一定不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com