
分析 NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,加盐酸检验碳酸钠会干扰NaCl检验,则加硝酸检验碳酸钠,剩余三种物质中与硝酸钡反应生成沉淀的为Na2SO4溶液,最后对剩余的两种物质中与硝酸银反应生成白色沉淀的为NaCl,则另一无现象的为NaNO3溶液,以此来解答.
解答 解:(1)加盐酸检验碳酸钠会干扰NaCl检验,则加稀硝酸检验碳酸钠,即出现气泡的为Na2CO3溶液,发生的离子反应为CO32-+2H+=H2O+CO2↑,
故答案为:稀硝酸;气泡;Na2CO3溶液;CO32-+2H+=H2O+CO2↑;
(2)剩余三支试管中分别滴入Ba(NO3)2溶液,出现白色沉淀的是Na2SO4溶液,发生的离子反应为Ba2++SO42-=BaSO4↓,
故答案为:Ba(NO3)2溶液;白色沉淀;Na2SO4溶液;Ba2++SO42-=BaSO4↓;
(3)剩余两支试管中分别滴入AgNO3溶液,出现白色沉淀的是NaCl溶液,而三次实验中都没有明显现象的是NaNO3溶液,涉及离子反应为Ag++Cl-=AgCl↓,
故答案为:AgNO3溶液;白色沉淀;NaCl溶液;Ag++Cl-=AgCl↓.
点评 本题考查物质的检验实验方案的设计,为高频考点,把握物质的性质及检验时发生的反应、现象为解答的关键,注意检验物质中不能引入干扰离子,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
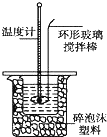 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸根中可能含有氧元素 | B. | 正盐中一定不含氢元素 | ||
| C. | 碱中一定含有氢元素和氧元素 | D. | 酸式盐中含有氢元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如表:
已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的pH如表:| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | - | - |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4↓+Al(OH)3↓ | |
| B. | C点对应的沉淀是:Fe(OH)3和BaSO4 | |
| C. | OA段可能发生的反应是:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓ | |
| D. | 据图计算原溶液中:c(Cl-)=c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com