
我国化学家在“铁基(氟掺杂镨氧化铁砷合物)高温超导”材料研究上取得了重要成果,给研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)Fe在周期表的位置为
(2)氟、氧、砷三种元素中电负性最小的是__________(用元素符号填空)。
(3)氧的最简单氢化物键角为 ,砷的最简单氢化物分子空间构型为 。
(4)FeCl3晶体易溶于水,乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因: 。
(5)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如图。

①已知CN-与N2结构相似,1molCN-中π键数目为 。
②上述沉淀溶解过程的化学式为
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高一上学期期中化学试卷(解析版) 题型:实验题
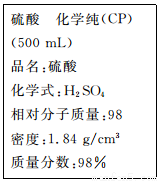
(1)该硫酸的物质的量浓度为____________mol/L。
(2)某化学小组进行硫酸酸性实验探究时,需要240 ml,4.6 mol.L-l的稀硫酸,则在配制时需要取上述浓硫酸_____________mL。
(3)叙述将上述浓硫酸进行稀释的实验操作:____________________。
(4)在配制4.6 mol.L-l稀硫酸的过程中,下列情况对所配制的硫酸溶液的物质的量浓度有何影响?
①用量筒量取浓硫酸时俯视量筒刻度线_____________(填“偏高”、“偏低”或“无影响”,下同);
②未经冷却趁热将溶液注入容量瓶中:_____________;
③仰视容量瓶刻度线定容:__________________;
④移液时不慎将少量溶液滴在容量瓶外面:_____________;
(5)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水,液面离容量瓶颈刻度线下1~2 cm时,应_____________。
②加蒸馏水时不慎超过了容量瓶颈刻度线,应_____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:填空题
(1)按要求完成下列反应的化学方程式
① 过氧化钠与与水反应___________________
② 氯气与氢氧化钠溶液反应___________________
(2)按要求写出有关反应的离子方程式
① 三氧化二铁和盐酸反应________________
② 硫酸氢钠与碳酸氢钠反应___________________
③ 氢氧化钡与氯化铵溶液混合___________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:选择题
下列反应中必须加入还原剂才能进行的是( )
A.Cl2→Cl- B.CO2→C C.Zn→Zn2+ D.CuO→CuCl2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高一上期中化学卷(解析版) 题型:选择题
下列溶液中,跟100ml0.5mol/LNaCl溶液所含的Cl-物质的量浓度相同的是( )
A.100ml0.5mol/LMgCl2溶液
B.200ml0.25mol/LCaCl2溶液
C.50ml0.51mol/LNaCl溶液
D.25mL0.5mol/LNaClO溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高二上期中化学卷(解析版) 题型:选择题
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液;在深蓝色溶液中加入等体积的95%乙醇,深蓝色溶液变浑浊,静置后有深蓝色晶体析出。下列对此现象说法正确的是
A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.[Cu(NH3)4]2+的空间构型为平面正方形,中心离子Cu2+采用sp3杂化
C.[Cu(NH3)4]SO4会与乙醇发生反应生成深蓝色晶体
D.[Cu(NH3)4]SO4含有NH3分子,其水溶液中也含有NH3分子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高二上期中化学卷(解析版) 题型:选择题
几种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性。下列说法不正确的是
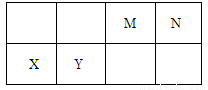
A. 元素的第一电离能X<Y
B. X位于第三周期IIA ,其单质可采用电解熔融其氯代物制备
C. 元素最高价氧化物的水化物中,酸性最强的是HNO3
D. 气体分子(MN)2的电子式为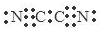
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省赣州市十四校高二上学期期中化学试卷(解析版) 题型:填空题
按要求填写下列问题:
(1)某些共价化合物(如H2O、NH3、N2O4等)在液态时会发生微弱的电离,如:2H2O  H3O+ + OH—,则液态NH3电离的方程式是
H3O+ + OH—,则液态NH3电离的方程式是
(2)某温度(t℃)时,测得0.01mol/L的NaOH溶液的pH=10,则该温度下水的KW= ,在此温度下,将pH=b的NaOH溶液Vb L与pH=a的H2SO4溶液Va L混合,若所得混合液为中性,且a+b=13,则Va:Vb=
(3)25℃时,0.1mol/L的HA溶液中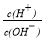 =1010.请回答下列问题:
=1010.请回答下列问题:
①HA是 (填“强电解质”或“弱电解质”).
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母)
A.c(HA) B.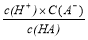 C.c(H+)与c(OH-)的乘积 D.c(OH-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
(4)在常温下,中和相同体积,相同pH的Ba(OH)2、NH3•H2O、NaOH三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3,则三种关系为 (用“V1、V2、V3”和“>、<、=”表示).
(5)今有A盐酸、B醋酸、C硫酸 三种酸:
①在同体积、同浓 度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是 .(填写酸的序号并用符号“>、<、=”连接,下同)
度的三种酸中,分别加入足量的碳酸氢钠粉末,在相同条件下产生CO2的体积由大到小的顺序是 .(填写酸的序号并用符号“>、<、=”连接,下同)
②在同体积、同pH的三种酸中,同时加入形状、密度、质量完全相同的锌粒,若产生相同体积的氢气(同温同压下),则开始反应时速率大小关系 是 ,反应所用时间长短关系是
是 ,反应所用时间长短关系是
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省辽源市高一上学期期中化学卷(解析版) 题型:选择题
下列离子方程式书写不正确的是
A.制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+
B.H2SO4溶液中投入锌粒:2H++Zn═H2↑+Zn2+
C.用NaHCO3治疗胃酸过多:HCO3-+H+═CO2↑+H2O
D.氯化铁和氢氧化钾溶液混合:Fe3++3OH-═Fe(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com