
| A、实验室制取D时,使用水浴加热 |
| B、A能与溴水和酸性KMnO4溶液发生氧化还原反应,而使它们褪色 |
| C、D的同分异构体中含有羧基的有3种 |
| D、B和C的熔点和沸点都比C2H6、C2H4的沸点和熔点高 |


科目:高中化学 来源: 题型:
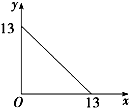 T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )
T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )| A、T℃时,水的离子积Kw为1×10-13 |
| B、T>25 |
| C、T℃时,pH=7的溶液显碱性 |
| D、T℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol?L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol?L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL | B、5mL |
| C、大于5mL | D、小于5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
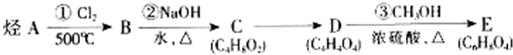
| ④ |
| ⑤KMnO4/H+ |
| ⑥ |
| ⑦酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 NO3-+
NO3-+ ═
═ Fe2++
Fe2++ NH4++
NH4++
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4 |
| B、C4H8 |
| C、C4H10 |
| D、C5H10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com