

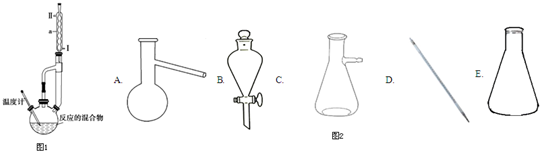
分析 本题是探究实验室制制取乙酸乙酯,涉及类似于浓硫酸稀释一样配制反应混合液,为了防止暴沸需要添加碎瓷片,实验中浓硫酸的作用,以及实验现象和反应后产物的分离提纯,可据此分析作答;
【装置设计】装置中②的导管不能伸入液面以下,否则容易发生倒吸现象,则装置甲会发生倒吸现象,装置乙合理;丙中球形干燥管还可以防止倒吸;
【实验步骤】混合溶液的配制一般是密度大的加到密度小的液体里,可参考浓硫酸的稀释方法来配制混合溶液;
(1)浓硫酸有吸水性且做催化剂加快反应速率;
(2)饱和碳酸钠溶液能够除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;
(3)乙酸乙酯不溶于饱和碳酸钠溶液,所以试管②中混合液分层,上层为有油状液体;
(4)液体混合物加热时需要防暴沸,添加碎瓷片可达到目的.
解答 解:【装置设计】乙酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用,故答案为:乙;防止倒吸;
【实验步骤】在试管①中先加入3mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸,故答案为:在试管①中加入3mL的乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸;
(1)浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作催化剂和吸水剂,故答案为:催化、吸水;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,故答案为:饱和碳酸钠溶液;降低酯在水中的溶解度,除去酯中混有的酸和醇,使其容易分层;
(3)乙酸乙酯在饱和碳酸钠溶液的溶解度较小,所以会过程中试管②中液体分为两层(有水果味),故答案为:液面上有透明的不溶于水的油状液体产生,并可以闻到香味;
(4)为防止液体混合物加热,需要加碎瓷片,故答案为:防止暴沸.
点评 本题考查了乙酸乙酯的反应原理及实验室制法,题目难度不大,注意掌握乙酸乙酯的制备方法及反应原理,明确饱和碳酸钠溶液、浓硫酸在实验中的作用为解答本题的关键.


科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:实验题
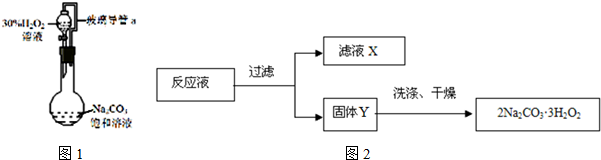
CuSO4溶液与K2C2O4溶液棍合反应,产物之一是某种只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 ml水加热,用0.2000 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mlKMnO4溶液。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 ml Na2S2O3溶液。已知涉及的部分反应的离子方程式为:
I2+2S2O32-=2I+S4O62-
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu )≤1.0×10-6 mol·L-1,应保持溶液中c(I-)≥ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2,同时生成Mn2+。写出该反应的离子方程式为 若无此加热操作,则测定的Cu2+的含量将会 (填“偏高”、“偏低”或“不变”)。
(3)步骤b中第一步反应的方程式为 ,若用淀粉溶液做指示剂,则滴定终点观察到的现象为 。
(4)通过计算确定样品晶体的组成。(请写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 相对分 子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物 质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ•mol-1)的变化:关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H>0,△S>0 | D. | △H<0,△S>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com