
| A. | 在烧瓶中装约$\frac{1}{3}$体积的自来水,并放入几粒沸石防暴沸 | |
| B. | 若使用温度计须将温度计水银球插到自来水中 | |
| C. | 冷水从冷凝管下口入,上口出 | |
| D. | 收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 |
分析 A、蒸馏过程中烧瓶内液体易暴沸;
B、蒸馏操作是得到不同温度的馏分,需要用温度计控制馏分的沸点;
C、冷凝管中的冷却水遵循逆流原则;
D、收集到的液体为纯净的水,不含氯离子.
解答 解:A.为避免加热时出现暴沸现象,在蒸馏烧瓶中盛约1/3体积的自来水,并放入几粒沸石,故A正确;
B.将温度计水银球放在蒸馏瓶的支管口处,测馏分的沸点,不能插到自来水中,故B错误;
C.冷水从冷凝管上口入,下口出,冷凝效果好,故C正确;
D.收集到的液体为纯净的水,不含氯离子,则取少量滴入硝酸银和稀硝酸,无明显现象,故D正确;
故选B.
点评 本题考查了蒸馏水制备的实验,题目难度不大,关键在于能够掌握蒸馏操作的原理和注意事项,注意相关实验操作知识的积累.


科目:高中化学 来源: 题型:解答题
 己知A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加.A元素核内只有质子,B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D原子核外电子排布为nsnnpn+2,E是第四周期元素,最外层只有一个电子,其余各层电子均充满.
己知A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加.A元素核内只有质子,B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D原子核外电子排布为nsnnpn+2,E是第四周期元素,最外层只有一个电子,其余各层电子均充满.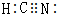 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
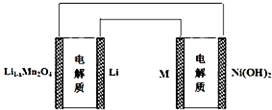
| A. | 锂离子电池放电时Li+向正极迁移 | |
| B. | 锂离子电池充电时,阴极的电极反应式:LiMn2O4-xe-═Li1-xMn2O4+xLi+ | |
| C. | 如图表示用锂离子电池给镍氢电池充电 | |
| D. | 镍氢电池放电时,负极的电极反应式:MH+OH--e-═H2O+M |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4 和 Ba(OH)2 | B. | NaAlO2和HCl | C. | Na2CO3和 HCl | D. | AlCl3和 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
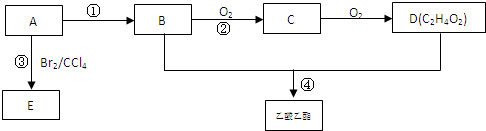
 CH3COOCH2CH3+H2O:反应类型:酯化反应.
CH3COOCH2CH3+H2O:反应类型:酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 能使酸性KMnO4溶液褪色 | |
| B. | 1 mol该化合物和足量的钠反应生成1 mol H2 | |
| C. | 能与溴发生取代反应和加成反应 | |
| D. | 1 mol该化合物最多与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com