
分析 依据热化学方程式书写方法解答,标注物质聚集状态和反应焓变;根据H元素守恒计算CH4的物质的量,进而计算CO的物质的量.
解答 解:在298K,100kPa时.CH4的燃烧热是890.0kJ/mol,在298K时,1mol CH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ,则该反应的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol,
18克液态水的物质的量=$\frac{18g}{18g/mol}$=1mol,根据H原子守恒可知n(CH4)=$\frac{1mol×2}{4}$=0.5mol,故n(CO)=0.75mol-0.5mol=0.25mol,
则CH4和CO的物质的量的比为2:1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O△H=-890.0kJ/mol;2:1.
点评 本题考查热化学方程式书写、热化学方程式计算,热化学方程式定量计算、元素守恒等计算是解答本题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑤ | C. | ③④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和SiO2 | B. | CO2和SiO2 | C. | NaCl和 HCl | D. | 钠和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定溶液的酸碱性时,应先用蒸馏水将其润湿 | |
| B. | 利用焰色反应鉴定样品中是否含有K+时,应透过蓝色钴玻璃观察火焰的颜色 | |
| C. | 在中和滴定过程中,视线应始终注视滴定管内的液面变化 | |
| D. | 将溴水中的溴单质提取出来,应使用酒精作萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:
已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B | B. | 原子序数:A>B | ||
| C. | 原子最外层电子数:B>A | D. | 元素所在的周期数:A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
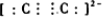 ,其中α键和π键数目之比为1:2.
,其中α键和π键数目之比为1:2.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质与乙炔互为同系物 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 不能发生加聚反应 | |
| D. | 可由乙炔和含氮化合物通过取代反应制得 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com